【文献分享】一种NT-proBNP替代抗原的成本效益优化策略
Ruan Y等人提出了一种构建NT-proBNP替代抗原的策略。以第10人纤维连接蛋白III型(FN3)为蛋白支架,将编码NT-proBNP两个抗原表位的碱基序列通过4GS或polyN连接体融合到FN3的FG环区和C端,再用大肠杆菌表达系统对融合蛋白(分别命名为FN3-epitopes-4GS和FN3-epitopes-polyN)进行低成本的表达和纯化。Western blot分析、ELISA、血清稳定性测试和差示扫描量热分析等一系列检测结果表明,FN3可用于构建双抗原表位、且具有良好免疫反应性的稳定NT-proBNP替代抗原。利用大肠杆菌表达系统可高效生产FN3 NT-proBNP替代抗原且成本低,该策略在生物大分子替代抗原的生产方面具有潜在的应用前景。
1.为什么要做NT-proBNP替代抗原
N末端脑利钠肽前体(NT-proBNP)在人血清中的浓度很低,且经常被其他高浓度的蛋白污染,细胞培养成本高且容易降解,因此想要纯化天然NT-proBNP制备标准抗原并不容易。
2.为什么选择FN3做支架蛋白制备替代抗原
第10人纤维连接蛋白III型(FN3)是开发非抗体结合域特别成熟的支架,被广泛应用于工程化新型结合蛋白;一些基于FN3的生物分子已被开发用于临床治疗和诊断。FN3具备以下特点:
1)结构简单
2)N端或C端非常灵活,可以在不破坏附近结构二级构象的情况下延伸,被认为是一个合理、规则的抗原表位区域。
3)不含二硫键或游离巯基,有助于其在高温(Tm =87°C)和还原环境的稳定性。
4)三个灵活的表面环结构(BC、DE和FG)与抗体可变区相似,BC和FG环中氨基酸序列的变化不会影响FN3大分子衍生物的稳定性。据报道,FG环的氨基酸序列可以耐受高度人工引入的序列多样性,且不会改变衍生物的稳定性或溶解度。
5)FN3缺乏半胱氨酸残基,可在大肠杆菌等细菌的细胞质中高表达。
FN3独特的结构特征、优越的生物物理特性及其与许多分子的相容性为制备检测试剂盒中稳定替代抗原提供了有利条件。
3.设计思路
抗体与靶标的结合大多是高度特异性的。因此,一种抗体只能识别抗原的特定部分——“抗原表位”。抗原表位的展示是体外生产替代抗原的关键步骤。研究表明,线性表位与不连续构象表位不同,是由氨基酸序列而不是三维形态决定的。因此,将特定的线性抗原表位偶联到大分子载体上替代全长抗原作为免疫原是一种可行的方法。目前NT-proBNP免疫的确切线性表位得到了很好的研究,可以通过稳定的支架蛋白(如FN3)融合表达NT-proBNP的短线性表位肽,并利用大肠杆菌表达系统以低成本促进生产、纯化和检测。
3.1NT-proBNP表位的选择
无论是在人类血液中还是在真核细胞中重组表达的NT-proBNP分子,中心部分都存在o糖基化修饰。因此,建议使用NT-proBNP的N端或C端特异性抗体对血清NT-proBNP进行精确定量测量。此外,有报道称NT-proBNP分子中心部分(28-45和46-60肽)的特异性抗体在免疫测定中很少与人血液样本中的抗原结合。本研究选取NT-proBNP两端的表位(线性表位12-21和62-73)工程化FN3。
3.2 NT-proBNP表位插入位点的选择
选择FN3晶体结构中相距较远的C端和FG环,以减少相邻两个抗原表位之间局部构象的影响,还可通过灵活的连接体[如polyN(SSNNNNNNNNNN)或4GS(GGGGS)]将表位分开。
4.核心试验概述
4.1质粒构建
首先合成编码支架蛋白FN3的基因(其FG环和C端被NT-proBNP的两个表位取代)。通过NcoⅠ和HindⅢ位点克隆到pET28a(+)载体上。此外,编码4GS连接子或polyN连接子的基因被引入表位62-73上游,产生两个相似但不同的质粒[命名为pET28a (+)-FN3-epitopes-4GS和pET28a (+)-FN3-epitopes-polyN]。DNA测序结果显示表位DNA和连接子成功插入质粒。
4.2同源性建模
为了获得末端线性表位的三维结构,利用RaptorX (http://www.raptorx.uchicago.edu/)进行同源性建模。首先从RCSB PDB数据库(PDB:1FNA)中检索FN3的氨基酸序列,以作为同源性建模的靶点。利用RaptorX进行蛋白质二级结构预测和基于模板的三级结构建模。最后在PyMOL中对两个蛋白结构进行比对(The PyMOL Molecular Graphics System,版本1.5.0.3)。
4.3蛋白质的表达和纯化
为制备显示NT-proBNP两个表位的重组FN3蛋白(简称FN3-epitopes),将质粒pET28a(+)-FN3-epitopes-4GS或pET28a(+)-FN3-epitopes-polyN转入大肠杆菌BL21(DE3)。挑取单个菌落,将培养物以1/100的比例接种于含卡那霉素的LB培养基中,37℃过夜培养。OD600达到0.4-0.6时,加入0.2mM异丙基β-D-1-硫代半乳糖苷(IPTG),在 25℃摇床上继续培养,诱导FN3-epitopes表达,6小时后离心收集细胞。细胞经超声破碎,12000g离心后即可获得粗产物。将含有目标蛋白的细胞裂解上清液在40°C下加热10min。然后高速去除沉淀,获得上清液,加入到HisTrap™HP中进行纯化。通过SDS-PAGE或Western blot分析检测目标蛋白的表达和纯化情况,用BCA检测试剂盒测定蛋白浓度。
4.4验证
研究团队进行了热变性实验、Western Blot分析、可溶性蛋白检测、抗原结合能力的评价、差示扫描量热法(DSC)及FN3-Epitopes-polyN血清稳定性试验(详细信息见原文)。
5.结果
5.1FN3-Epitopes的结构
选择NT-proBNP表位序列12-21和62-73,在FN3空间结构上距离相对较远的两个位置(FG环和C端)分别植入,以避免两个表位之间可能发生的相互作用。FN3 FG环区氨基酸序列RGDSPASSK被NT-proBNP表位12-21取代,NT-proBNP的62-73表位与FN3的C端重组。此外,在FN3结构域引入polyN (SSNNNNNNNNNN)或4GS(GGGGS)连接子,将NT-proBNP两个表位融合到FN3结构域,以保证靶蛋白的正常功能,重组蛋白分别命名为FN3-epitopes-polyN和FN3-epitopes-4GS(图1)。额外的连接子KKGKGKKGK,可以促进重组蛋白(FN3-epitopes,即FN3-epitopes-polyN和FN3-epitopes- 4GS)与其他分子的偶联,如生物素和过氧化物酶。
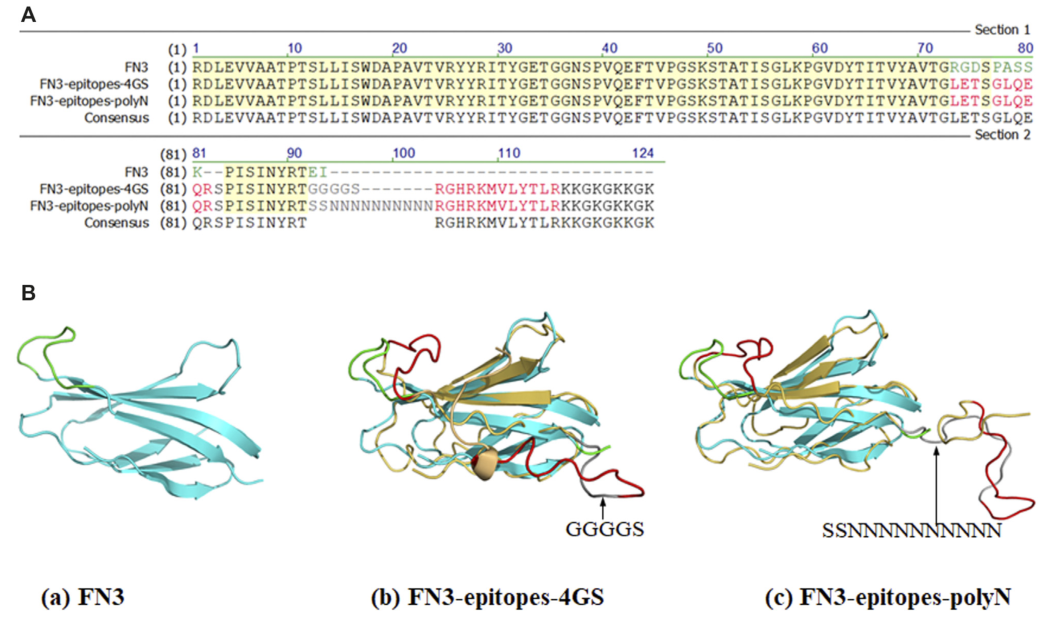
图1. FN3、FN3-Epitopes的部分序列和结构
注:(A)NT-proBNP表位修饰的FN3蛋白部分序列。绿色字母代表FN3的FG环(RGDSPASSK)区域或C端(EI),红色字母代表FG环插入的NT-proBNP表位12-21 (LETSGLQEQR)或C端插入的表位62-73 (RGHRKMVLYTLR)。灰色字母表示插入的4GS连接子或polyN连接子。(B)FN3的三维结构(青色)和NT-proBNP表位序列重组的FN3建模结构(表位12-21和62-73用红色线表示),4GS连接子或polyN连接子用深灰色线表示。FN3的骨架是青色的,它与黄色的同源模型重叠。
5.2FN3-Epitopes的表达
重组FN3-epitopes可被针对NT-proBNP不同氨基酸残基(13-27和61-76)的商业单克隆抗体识别。SDS-PAGE结果显示重组蛋白FN3-epitopes-polyN(16.7kDa)和FN3-epitopes-4GS(14.5kDa)在IPTG诱导的T7启动子的控制下表达(图2A,图2B)。Western blot分析表明,重组蛋白FN3-epitopes能够与所选抗体特异性结合(图2C,图2D)。
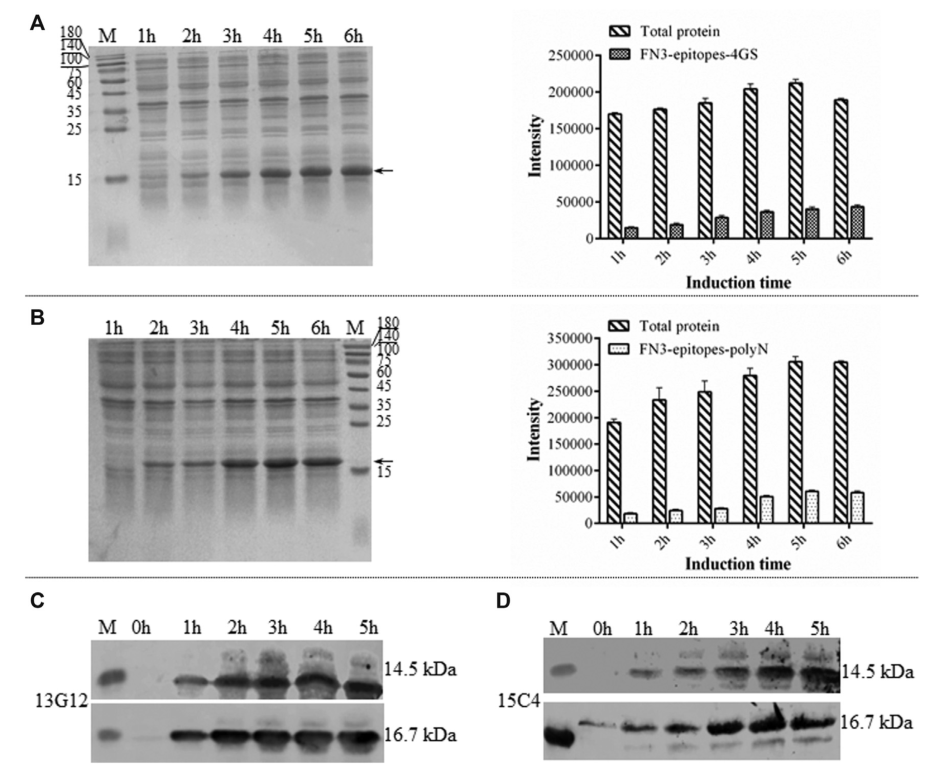
图2. 重组FN3-Epitopes在大肠杆菌中的表达
注:(A, B)诱导1-6小时后,通过SDS-PAGE分析蛋白FN3-epitopes-4GS (A)和FN3-epitopes-polyN (B)的表达情况,箭头所指为靶蛋白。(A, B)的右侧为SDS-PAGE图像的信号强度,数据为独立实验的平均值,误差条表示标准差。(C, D)Western blot分析FN3-epitopes-4GS(上图)和FN3-epitopes-polyN(下图)在指定诱导时间点的表达情况,(C)和(D)分别使用HRP标记的NT-proBNP(表位13-20)和NT-proBNP(表位63-71)抗体。(A, B,C, D)中的M为Marker。
5.3FN3-Epitopes的纯化
FN3-epitope在大肠杆菌中主要以可溶性形式表达(图3A,图3B)。在相似蛋白表达水平下,蛋白FN3-epitopes-4GS的纯化效率明显低于蛋白FN3-epitopes-polyN(图3C,图3D)。此外,为便于亲和层析纯化,研究人员进行了热变性实验,检测不同温度条件下(37-70℃)FN3-epitopes-polyN蛋白的降解水平。结果表明,随着温度的升高,FN3-epitopes-polyN蛋白逐渐从上清转移到沉淀。在40℃下,大约30%的异源蛋白析出,而60%的目标蛋白仍存在于上清中(图3E,图3F;详细信息见补充图1)。利用这种热稳定性,研究人员优化了纯化工艺,将FN3-epitopes-polyN细胞裂解液的上清加热到40°C,然后在进行金属螯合层析,从而获得更高质量的纯化蛋白(~ 40mg/L)。SDS-PAGE结果显示,重组蛋白FN3-epitopes-polyN的纯度约为100%(图3D);这些蛋白无需进一步纯化,可作为校准品或标准品。
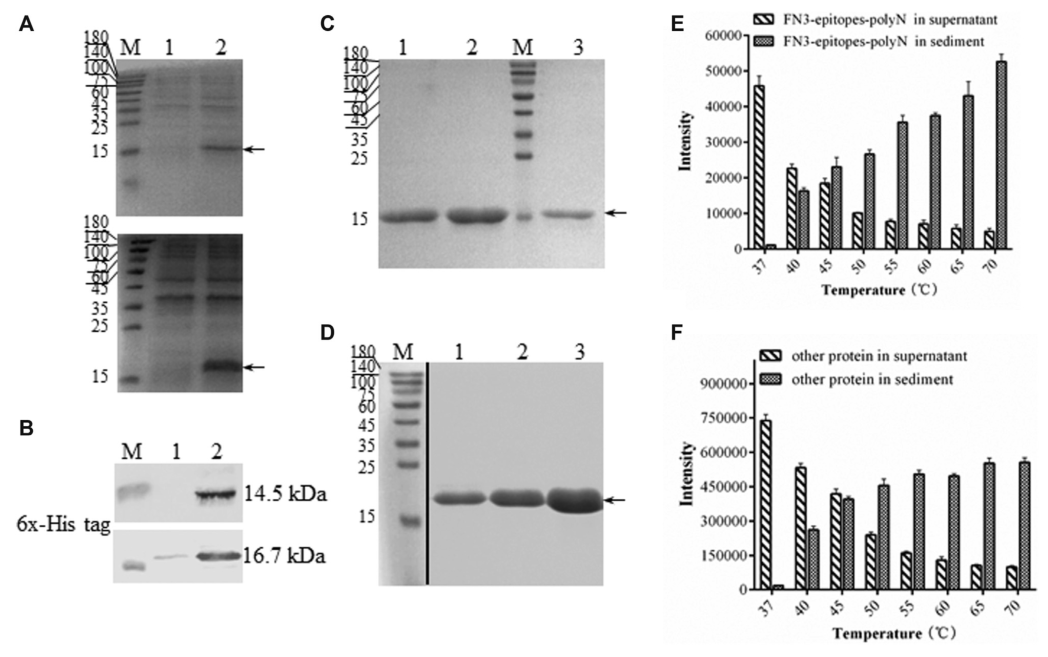
图3. 重组FN3-epitopes的溶解性和纯化
注:(A,B)分别为大肠杆菌BL21(DE3)中表达的可溶性FN3-epitopes-4GS(上图)和FN3-epitopes-polyN(下图)的SDS-PAGE和Western blot结果。箭头所指为靶蛋白FN3-epitopes-4GS(14.5kDa)或FN3-epitopes-polyN(16.7kDa)。Lane 1为总蛋白裂解物的沉淀;Lane 2为总蛋白裂解液上清。(C, D)为通过HisTrap™分离纯化FN3-epitopes-4GS(C)和FN3-epitopes-polyN(D)的SDS-PAGE结果。(C)中Lane 1-3的蛋白用60mM咪唑依次洗脱;(D)中Lane 1-3的蛋白用80mM咪唑依次洗脱。(E, F)为FN3-epitopes-polyN(E)和除FN3-epitopes-polyN外的其他蛋白(F)的热降解直方图,数据为独立实验的平均值,误差条表示标准差。(A, B,C, D)中的M为Marker。
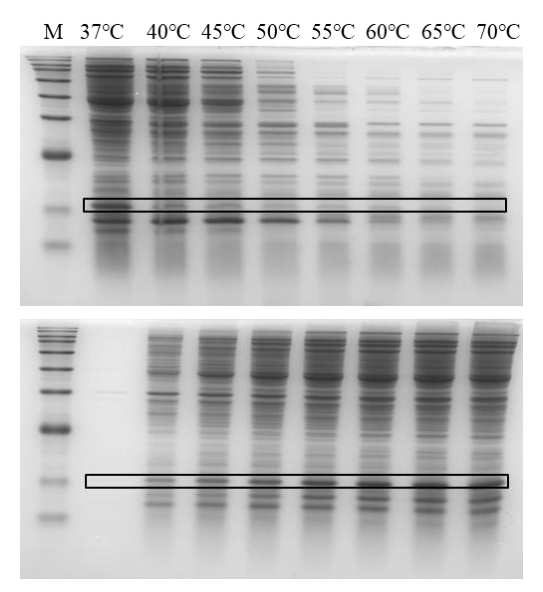
补充图1. SDS-PAGE分析不同温度条件下的热降解检测
注:目标蛋白用黑框圈出。上图为上清液中总蛋白。下图为沉淀物中的总蛋白质。M为Marker。
5.4FN3-Epitopes的抗原反应性
以野生型FN3为阴性对照,采用双抗体夹心ELISA法系统评价重组FN3-epitopes-polyN和FN3-epitopes-4GS的免疫反应性。结果显示两种重组FN3-epitopes与特异性抗体均具有良好的线性关系,其中FN3-epitopes-polyN在0.06~12.85ng/ml范围内,标准曲线r2大于0.99(图4B, 补充图2)。与FN3-epitopes-4GS相比,FN3-epitopes-polyN在低浓度下表现出更好的亲和力。综上所述,NT-proBNP的双表位可以在FN3结构域上成功展示,并保持其原有的高抗原反应性。本研究重点分析了易于纯化和亲和力较好的重组蛋白FN3-epitopes-polyN。
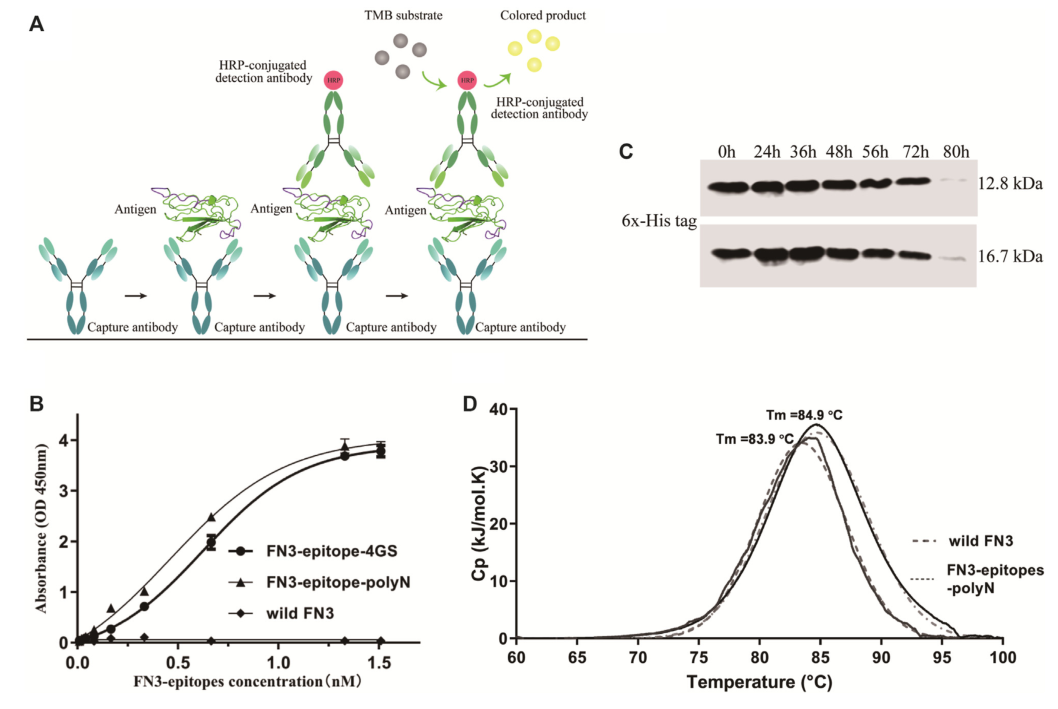
图4. 重组蛋白FN3-epitopes-polyN的免疫反应性和稳定性检测
注:(A)夹心ELISA方案。(B)夹心ELISA法检测免疫反应性。捕获和检测抗体分别为NT-proBNP(表位63-71)和酶标NT-proBNP(表位13-20)抗体,底物溶液为TMB。(C)Western blot分析血清FN3蛋白(上图)和FN3-epitopes-polyN(下图)的稳定性。(D)DSC热稳定性检测显示,FN3-epitopes-polyN(Tm= 83.9°C)和野生型FN3(Tm= 84.9°C)具有相似的高Tm值。
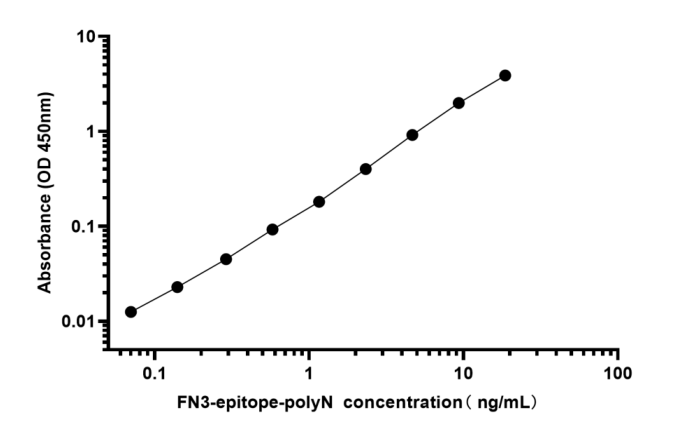
补充图2. 夹心ELISA检测抗原反应性
注:捕获抗体为NT-proBNP(63-71)抗体(3.5μg/mL),检测抗体为酶标NT-proBNP(13-20)抗体(0.35μg/mL),底物溶液为TMB,检出限为0.06ng/mL。
5.5FN3-Epitopes-polyN的体外稳定性
为了明确两个额外表位的融合是否对重组蛋白的稳定性有影响,研究人员进一步验证了FN3-epitopes-polyN的血清稳定性和热稳定性。体外重组蛋白FN3-epitopes-polyN的血清稳定性检测是在正常人血浆中进行的。结果表明,与非工程化FN3相似,在正常人血浆中37℃孵育80 h后,FN3-epitopes-polyN降解(图4C)。DSC结果显示,FN3-epitopes-polyN蛋白检测只有一个单峰(Tm=83.9°C),且与野生型FN3的Tm值相近(Tm=84.9°C),说明纯化后的FN3-epitopes-polyN蛋白保持了非工程化FN3的稳定性(图4D)。上述稳定性试验表明,重组蛋白FN3-epitopes-polyN将是NT-proBNP抗原的高度稳定替代品。
6.总结
基于支架蛋白构建替代抗原是一种很有前景的成本效益优化策略。本研究以N末端脑利钠肽前体(NT-proBNP)的两个肽表位为例,提出了构建第10人纤维连接蛋白III型(FN3)替代抗原的策略。结果显示,基于FN3支架构建的NT-proBNP替代抗原具有与NT-proBNP相同的免疫反应性、良好的生物物理特性和稳定性;可以在大肠杆菌表达系统中快速高效地产生,相较于真核细胞表达或化学合成操作更简单、成本更低。
参考文献
Ruan Y, Chao S, Hu X, et al. FN3 Domain Displaying Double Epitopes: A Cost-Effective Strategy for Producing Substitute Antigens[J]. Front Mol Biosci, 2021,8:742617.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302