CEA(CEACAM5)抗体结合表位研究
癌胚抗原相关细胞粘附分子(CEACAM)包括CEACAM1、CEACAM3至CEACAM8、CEACAM16以及CEACAM18至CEACAM21,属于膜相关细胞表面的糖蛋白家族,它们在细胞粘附、信号传递及肿瘤转移过程中扮演着重要角色。这类分子在肺部、结直肠及胃部组织的某些肿瘤细胞中呈现出表达上调的现象,使其成为抗体-药物偶联物的一个极具潜力的靶标。CEACAM的胞外结构域(ECD)由重复的免疫球蛋白(Ig)样结构域组合而成,包含一个位于N端的免疫球蛋白可变(IgV)样结构域,以及数量可多达六个的免疫球蛋白恒定C2(IgC2)样结构域(分为A型和B型)。这些结构域在不同类型的CEACAM之间展现出了高度的序列一致性和结构相似性。此外,CEACAM的ECD还包含多达28个潜在的N-糖基化位点。糖基化的差异性对蛋白-蛋白相互作用及疾病发展进程具有显著影响。因此,为防止临床诊断时出现假阳性结果,或在免疫治疗中引发脱靶效应或靶外肿瘤毒性,CEACAM靶向抗体必须具备高度的特异性,以避免与其他类型的CEACAM发生交叉反应。
1.CEACAM5特异性抗体
Tusamitamab ravtansine(SAR408701)是一种针对CEACAM5(即CEA)的抗体-药物偶联物,用于治疗晚期非鳞状非小细胞肺癌(NSCLC)和其他实体肿瘤。其抗体成分tusamitamab靶向CEACAM5的A3-B3结构域,不与CEACAM1、CEACAM6或CEACAM8结合,这意味着A3-B3结构域表面存在独特的结合区域,赋予抗体特异性。
2.抗体抗原结合界面分析
为了了解tusamitamab与CEACAM5A3-B3的结合机制和特异性,研究人员采用了多种方法对结合界面进行了残基鉴定和结构分析。
2.1研究方法
1)利用低温电子显微镜(cryo-EM)描述CEACAM5 A3-B3结构域与tusamitamab抗原结合片段(tusa Fab)复合物的高分辨率结构。
2)通过表面等离子体共振(SPR)分析丙氨酸突变对CEACAM5与tusa Fab结合的影响,进一步表征结合界面。
3)通过氢-氘交换耦合质谱(HDX-MS)比较CEACAM5与tusa Fab结合前后氢-氘交换的差异,鉴定表位残基。
2.2研究结果
2.2.1cryo-EM结构分析
1)糖基化
tusa Fab和hCEACAM5A3-B3的结构完全由β链和β片组成(图1b)。hCEACAM5的A3和B3结构域具有典型的IgC2结构域β-三明治结构。研究人员在hCEACAM5A3-B3区域鉴定了7个聚糖,包括Asn612残基上的N-连接甘露糖,该甘露糖与tusa Fab重链Gly54和Gly56残基形成氢键(图1c)。
2)结合界面
hCEACAM5-tusa Fab结构揭示了tusa Fab的重、轻链与hCEACAM5A3-B3(主要在B3区)的结合。
A.重链结合界面
hCEACAM5-tusa Fab重链结合界面的掩埋表面积覆盖455Å2,涉及hCEACAM5 B3结构域的12个残基(Pro621至Ser626、Gln635至Val639和Phe641)和14个tusa Fab重链残基(Val28、Ser30至Asp33、Ser53和His99至Pro106)。
在这个界面中检测到一个由8个氢键组成的网络,有的氨基酸会形成多个氢键。特别是,tusa Fab重链残基Ser31与3个hCEACAM5残基(Gln635、Thr637和Val639);tusa Fab重链残基Ser104与3个hCEACAM5 残基(Ser622和Gln624);CEACAM5 Ser622与2个tusa Fab重链残基(Ser103和Ser104)。
虽然界面中的一些残基存在疏水效应,但大多数残基距离太远无法相互作用(>5 Å)。只在hCEACAM5 Phe641和tusa Fab重链Val28之间发现了1个潜在的疏水作用位点,残基间距为~4.2 Å。
B.轻链结合界面
hCEACAM5-tusa Fab轻链界面的掩埋表面积达到344 Å2,涉及12个hCEACAM5氨基酸(A3结构域:Asn509、Lys511、Val513、Asp588和Leu590;B3结构域:Pro621、Ser622、Gln624、His636、Asn659、Leu660、Ala661)和9个tusa Fab轻链氨基酸(Glu27、Asn28、Phe30、Ser31、Tyr32、Tyr49、Asn50、His91、Tyr92)。hCEACAM5残基Leu660、Lys511和Gln624分别与tusa Fab轻链残基Tyr32、Tyr92和Asn50形成氢键。
此外,该界面有一个疏水区,涉及4个hCEACAM5残基(Pro621、Leu590、Leu660和Ala661)和3个tusa Fab轻链残基(Phe30、Tyr32和Tyr92),这些残基在3.7 Å和4.7 Å距离上具有正ΔGsolv值。
值得注意的是,hCEACAM5 B3结构域中的Gln624与tusa Fab重链和轻链残基均形成氢键。hCEACAM5A3-B3和tusa Fab之间的结合界面相互作用不涉及盐桥或二硫键(图2)。
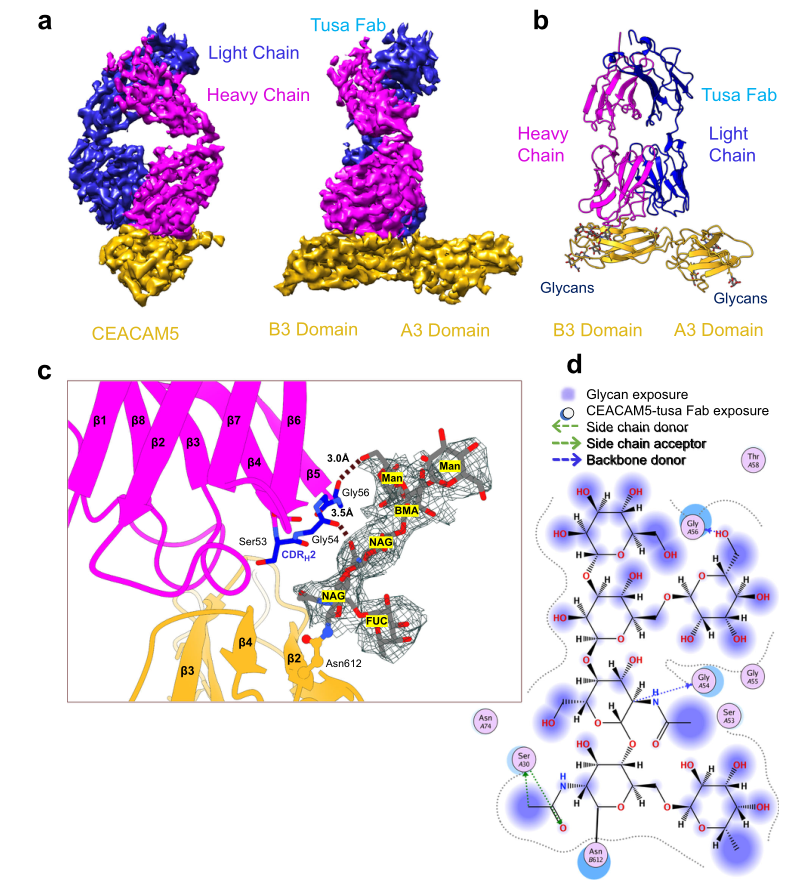
图1. hCEACAM5A3-B3与tusa Fab复合物的低温电镜结构
注:BMA:β-d-甘露糖;CDRH2:互补决定区重链2;CEACAM5:癌胚抗原相关细胞粘附分子5;cryo-EM:低温电镜;FUC:α-l-果糖;hCEACAM5:人癌胚抗原相关细胞粘附分子5;hCEACAM5A3-B3:人癌胚抗原相关细胞粘附分子5的A3-B3结构域;Man:α-d-甘露糖;NAG:N-乙酰-β-D-氨基葡萄糖;tusa Fab:tusamitama抗原结合片段。
hCEACAM5A3-B3与tusa Fab结合的Cryo-EM图谱。a.中右图为左图在纵轴上旋转90°视图。b.为hCEACAM5A3-B3(金带)与tusa Fab(洋红和蓝带)结合的带状结构示意图。箭头表示一个β链,圆棒表示N-链聚糖。c.hCEACAM5 B3(金带)结构域Asn612残基上的N-连接甘露糖与tusa Fab重链(洋红带)之间相互作用的放大视图。图中tusa Fab重链CDRH(蓝色)Gly54、Gly56与聚糖(深灰色)之间的相互作用用虚线表示。聚糖片段周围的线网表示模型与低温电镜密度图的拟合结果。d.分子操作环境(MOE)生成的聚糖配体相互作用图。hCEACAM5的相互作用残基用圆圈表示,A和B分别表示A3和B3结构域的残基。
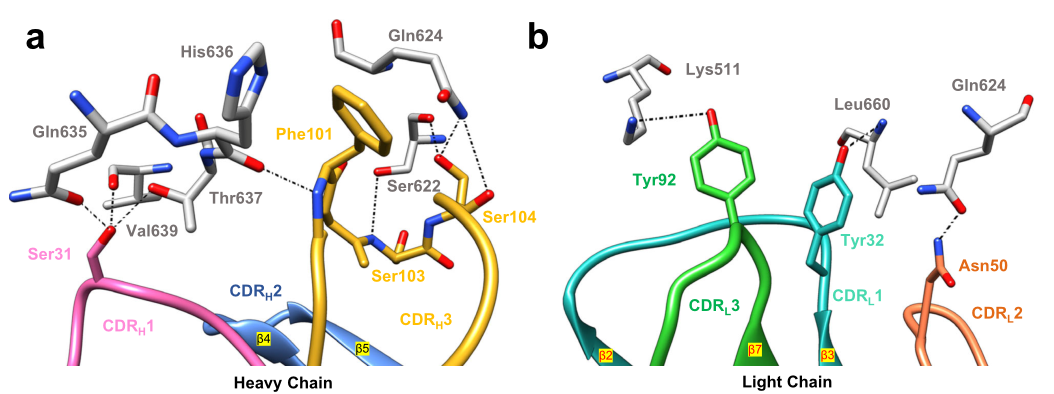
图2.hCEACAM5A3-B3与tusa Fab相互作用的关键表位
注:CDRH:重链互补决定区;CDRL:轻链互补决定区;hCEACAM5:人癌胚抗原相关细胞粘附分子5;hCEACAM5A3-B3:人癌胚抗原相关细胞粘附分子A3-B3结构域;tusa Fab:tusamitama抗原结合片段。
hCEACAM5的主架和侧链呈灰色。a.图中tusa Fab的CDRH1(洋红色)和CDRH3(黄色)通过与CEACAM5的B3结构域形成氢键网络来促进相互作用;虚线表示氢键。CDRH3的残基主要在CDRH3的Ser104、Ser103和Phe101与hCEACAM5 B3结构域的Ser622、Gln624和His636之间形成强氢键相互作用网络。CDRH1残基Ser31与hCEACAM5 B3结构域的Gln635、Val639和Thr637形成氢键。b.CDRL1(青色),CDRL2(珊瑚色)和CDRL3(绿色)与hCEACAM5A3-B3结构域相互作用。CDRL1的Tyr32、CDRL2的Asn50和CDRL3的Tyr92分别与hCEACAM5A3-B3结构域的Leu660、Gln624和Leu511形成氢键。
2.2.2SPR分析
在初始筛选中,重链上的5个变体(Asp33Ala、Phe101Ala、Gly102Ala、Gly105Ala和Pro106Ala)和轻链上的2个变体(Tyr32Ala和Asn50Ala)完全失去与hCEACAM5ECD的结合能力;重链中的4个变体(Tyr32Ala、Tyr50Ala、His99Ala和Tyr100Ala)和轻链中的4个变体(Phe30Ala、His91Ala、Tyr92Ala和Pro95Ala)与hCEACAM5的结合减弱。
此外,重链中的7个变体(Tyr32Ala、Asp33Ala、Tyr100Ala、Phe101Ala、Gly102Ala、Gly105Ala和Pro106Ala)和轻链中的2个变体(Tyr32Ala和Asn50Ala)完全破坏了hCEACAM5tusa Fab+Fc复合物的稳定性。重链中的另外两个变体(Tyr50Ala和His99Ala)和轻链中的4个变体(Phe30Ala、His91Ala、Tyr92Ala和Pro95Ala)导致复合物稳定性降低。
综上所述,这些发现表明tusa Fab抗体结合区包含重链的第三个互补性决定区(CDR3)(残基96-108)。来自重链CDR1(残基32和33)、轻链CDR1(残基32)和轻链CDR3(残基91和92)的一些残基也可能有助于抗体结合区相互作用。
在第二组SPR实验中,选择在SPR筛选实验中%Rmax和%Remaining与野生型(WT)不同的20个tusa Fab+Fc变体,进行进一步评估。值得注意的是,相对于tusa Fab+Fc WT(KD=14.0nM),重链中的2个变体(Tyr50Ala和His99Ala)和轻链中的4个变体(Phe30Ala、His91Ala、Tyr92Ala和Pro95Ala)与hCEACAM5ECD的结合亲和力降低(KD=306.5nM至13.5µM)(表1)。
表1.利用SPR分析丙氨酸突变对hCEACAM5与tusa Fab+Fc结合的影响
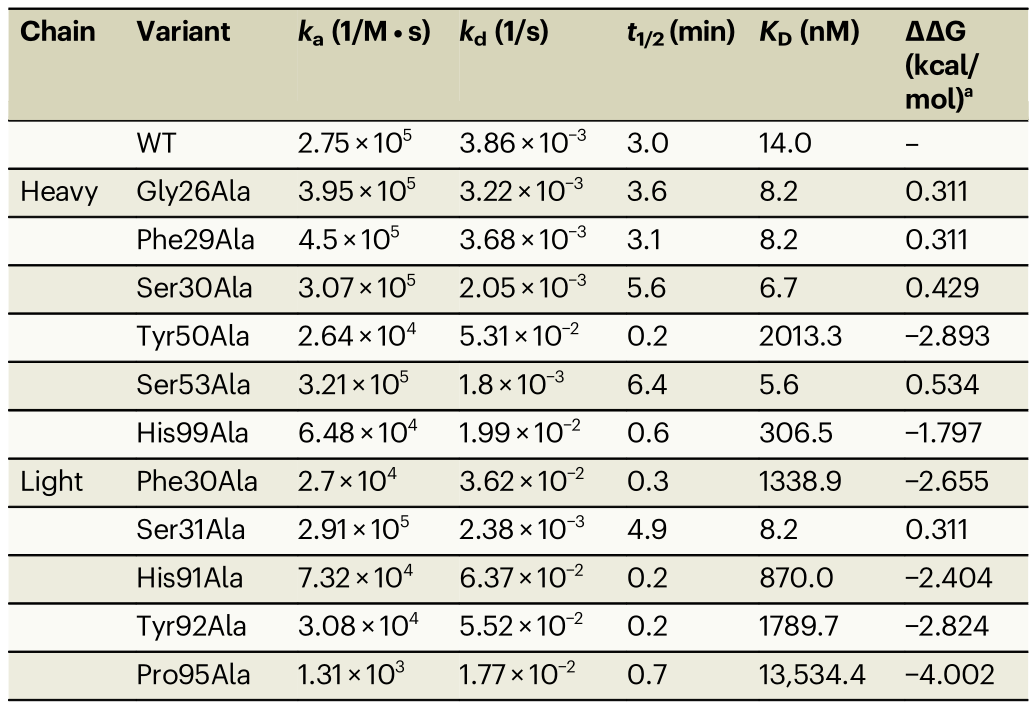
注:ka:结合常数,kd:解离常数,KD:结合常数,t1/2:解离半衰期,WT:野生型。
a.野生型tusa Fab和丙氨酸变体之间结合自由能变化(构象稳定性)的差异(ΔGWT -ΔGAla)。负值表明丙氨酸突变在能量上是不利的(即,需要比WT蛋白更多的能量来折叠)。
2.2.3HDX-MS分析
游离CEACAM5和CEACAM5-tusa Fab复合物氘摄取的差异表明CEACAM5表位涉及残基607-613和629-641。游离tusa Fab和CEACAM5-tusa Fab复合物氘摄取的差异表明tusa Fab结合表位涉及重链中的101-109残基和轻链中的48-54和88-104残基。
2.2.4小结
通过多种方法(cryo-EM,SPR和HDX-MS)鉴定出tusa Fab 表位中16个氨基酸残基(10个在重链上,6个在轻链上)(图3a)。当发生丙氨酸突变时,6个残基(重链:Tyr32、Asp33、Tyr100和Phe101;轻链:Tyr32和Asn50)与hCEACAM5A3-B3结合能力丧失,2个残基(轻链:Phe30和Tyr92)的结合能力变弱。
通过丙氨酸诱变鉴定的Tusa Fab表面残基大多与cryo-EM鉴定的残基一致(图3b)。综合来看,当聚集在低温电镜核心区域的残基突变为丙氨酸时,会导致与hCEACAM5结合能力丧失,而当距离更远的残基突变为丙氨酸时,会导致结合变弱。HDX法鉴定的hCEACAM5表位比低温电镜法鉴定的表位表面积小;然而,这两种方法检测到的相互作用核心区域都在B3结构域(图3c)。
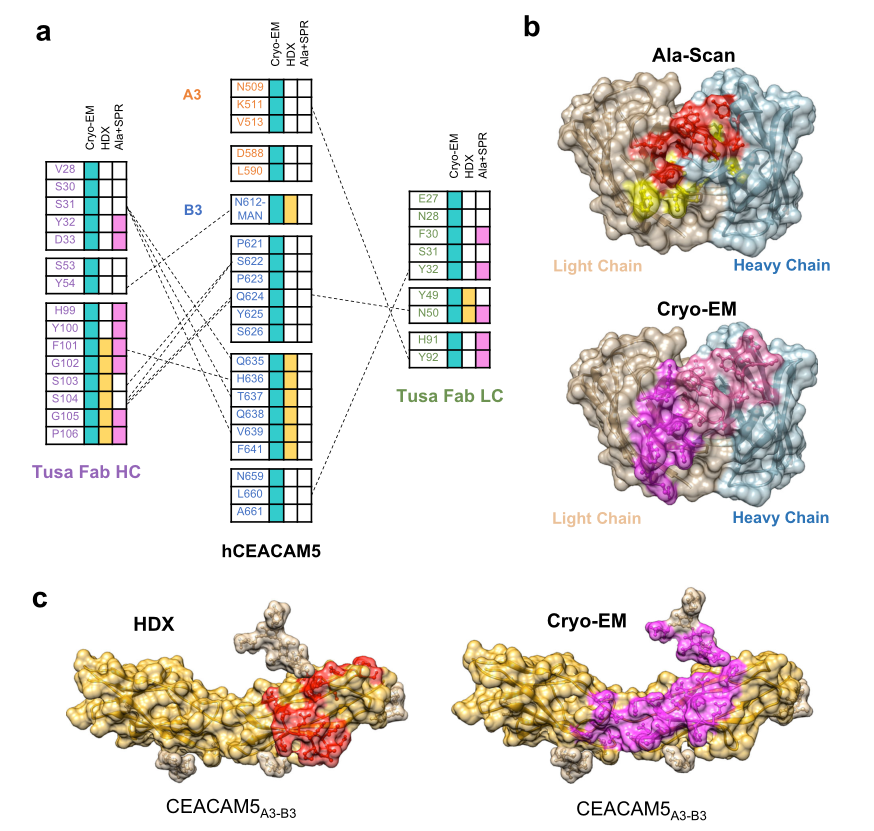
图3.hCEACAM5A3-B3与tusa Fab结合界面的不同分析技术鉴定结果
注:Ala-Scan,丙氨酸扫描诱变;Ala+SPR,丙氨酸变体的表面等离子体共振;cryo-EM,低温电子显微镜;HC,重链;hCEACAM5,人癌胚抗原相关细胞粘附分子5;hCEACAM5A3-B3,人癌胚抗原相关细胞粘附分子5的A3-B3结构域;HDX,氢-氘交换;LC,轻链;MAN,甘露糖;tusa Fab,tusamitamab抗原结合片段。
a.hCEACAM5A3-B3与tusa Fab复合物中相互作用残基的比较。氢键用虚线表示。b.通过丙氨酸诱变鉴定的tusa Fab表位残基(黄色高亮表示部分结合,红色高亮表示没有结合)和冷冻电镜(浅粉色高亮表示重链的相互作用残基,洋红色高亮表示轻链的相互作用残基)的比较,tusa Fab重链和轻链的溶剂可溶表面分别用浅棕色和浅蓝色表示。c.HDX(红色)和cryo-EM(洋红色)鉴定的hCEACAM5表位残基比较。hCEACAM5A3-B3和N-链聚糖的溶剂可溶表面分别为金棕色和浅棕色。b,c二级结构(较深的带状结构和球棍结构)。
2.3讨论
CEACAM蛋白家族中,CEACAM5独特表位的确定对理解其特异性结合至关重要,特别是A3-B3结构域的表位,对抗体-药物偶联机制具有重要意义。本研究通过cryo-EM、HDX-MS和SPR鉴定获得的CEACAM5A3-B3与tusamitamab(tusa Fab)结合表位基本一致。其中tusa Fab结合表位中的16个氨基酸残基与抗体特异性、亲和力有关。这些残基多属于芳香残基(Tyr、Trp和Phe)、短亲水侧链残基(Ser、Thr、Asp和Asn)或甘氨酸。这些残基聚集在重链上(特别是CDR3),通过氢键或范德华力稳定结合界面。16个残基中有6个突变为丙氨酸时,与hCEACAM5A3-B3结合能力丧失,2个突变后结合能力变弱。
hCEACAM5表位涉及A3和B3结构域;Tusa Fab主要结合B3结构域,与A3作用较少。hCEACAM5 B3结构域主要涉及6个残基(Ser622、Gln624、Gln635、His636、Thr637和Val639),特别是Gln624能同时与重链和轻链形成氢键。4个氢键残基(Gln635、His636、Thr637和Val639)和1个疏水残基(Phe641),可能对hCEACAM5表位至关重要。
此外,在B3结构域Asn612残基上的N-连接甘露糖与tusa Fab重链形成氢键。N-糖基化倾向于降低蛋白质的灵活性,增加蛋白质的整体稳定性。因此,hCEACAM5A3-B3中的所有N-连接聚糖,包括与Asn612连接的聚糖,可能在形成被tusa Fab和其他参与hCEACAM5细胞功能的蛋白质识别的整体构象中发挥重要作用。聚糖在CEACAM5中的作用很重要,因为在hCEACAM5-tusa Fab结合界面中没有盐桥。盐桥通过施加限制构象灵活性约束在抗体-抗原相互作用中发挥重要作用。Asn612残基上的N-连接甘露糖可能具有补偿和稳定功能,类似于没有盐桥的蛋白质复合物中的关键锚定残基;这将增加结合界面的刚性,从而提高tusa Fab对hCEACAM5A3-B3的特异性。
研究人员推断,tusa Fab对hCEACAM5的A3-B3结构域的特异性是由于tusa Fab重链和轻链与hCEACAM5A3-B3之间存在多种类型的相互作用,以及结合界面的构象约束(形状互补)。这种结合机制可能使tusamitamab能够将hCEACAM5与其他人类CEACAM(即CEACAM1、6和8)区分开,并将hCEACAM5中的A3-B3结构域与A1-B1和A2-B2结构域区分开。
参考文献
Kumar A, Duffieux F, Gagnaire M, et al. Structural insights into epitope-paratope interactions of a monoclonal antibody targeting CEACAM5-expressing tumors[J]. Nat Commun, 2024, 15(1):9377.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302