癌胚抗原(CEA)的结构及功能介绍
癌胚抗原(CEA),也被称作癌胚抗原相关细胞粘附分子5、CD66e以及胎粪抗原100(Meconium antigen 100),是免疫球蛋白超家族(IgSF)的成员之一。CEA借助糖磷脂酰肌醇(GPI)锚定机制固定在细胞膜上;当膜锚定区被磷脂酶C和磷脂酶D裂解时,CEA会进入循环系统。因此,CEA可以以膜蛋白和分泌蛋白两种形式存在。
健康的成年人体中,血清CEA水平普遍偏低。CEA表达异常、浓度升高可能与多种类型的癌症相关,包括结直肠癌、胃癌、乳腺癌、卵巢癌以及胰腺癌等。值得注意的是,CEA也存在于胎儿肠组织中,在某些非恶性疾病,如炎症性肠病中,也会出现血清CEA水平升高的现象。此外,在正常细胞中,CEA蛋白的分子量约为72 kDa,但在癌细胞系和癌症患者的样本中,检测到的CEA分子量高达180至200 kDa,表明癌细胞中CEA糖基化修饰增多且存在差异。
1.CEA的结构
CEA基因家族依据序列与功能的相似性分为三类:即CEA相关细胞粘附分子(CEACAM)、妊娠特异性糖蛋白(PSG)以及假基因。其中CEACAM类包含了12个基因成员,分别是CEACAM1、CEACAM3至CEACAM8、CEACAM16以及CEACAM18至CEACAM21。这些基因的蛋白质序列具有17-88%的相似性,并且蛋白质的胞外区均呈现出高度的糖基化修饰特征。
CEA由CEACAM组的CEACAM5基因表达,结构上包含7个免疫球蛋白样结构域,即一个可变(lgV)样结构域(N结构域)和六个lgC样结构域(A1、B1、A2、B2、A3、B3);lg结构域前有一个信号肽(1-34AA),后有一个为前体肽(686-702AA),前体肽成熟后会被移除。
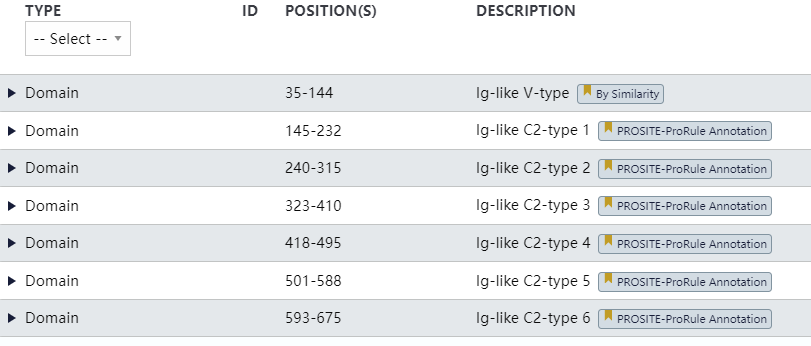
图1. CEA结构域
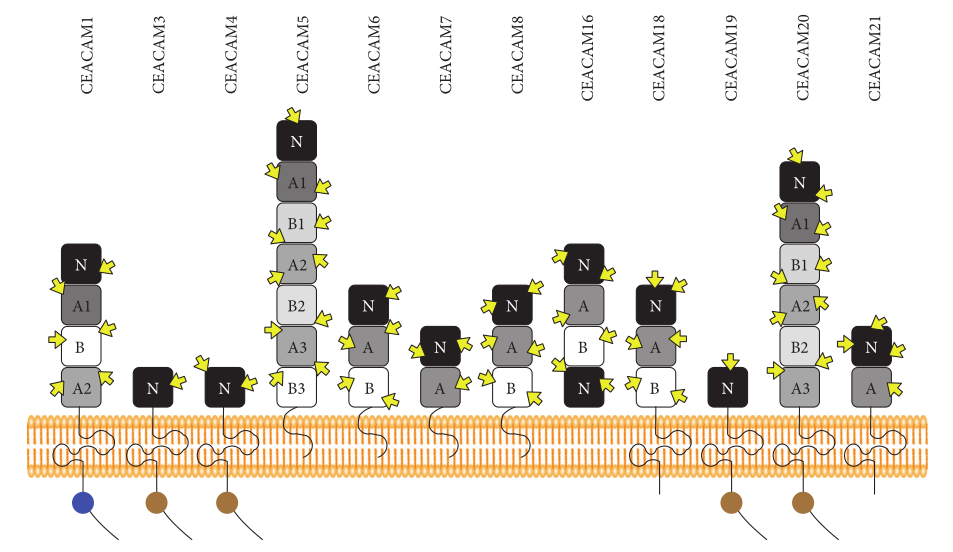
图2. CEACAM组成员示意图
注:CEACAM1、CEACAM3、CEACAM4、CEACAM19、CEACAM20和CEACAM21具有跨膜结构域,CEACAM5(CEA)、CEACAM6、CEACAM7和CEACAM8具有GPI连接的膜锚定特性。CEACAM3、CEACAM4、CEACAM19和CEACAM20具有免疫受体酪氨酸的激活基序(ITAM);CEACAM1具有免疫受体酪氨酸的抑制基序(ITIM);棕色圆圈代表ITAM,蓝色圆圈显示ITIM。CEACAM组成员有多个糖基化位点,用黄色箭头表示。
2.CEA的功能
细胞间的相互粘附及信号传导过程,往往依赖于膜性免疫球蛋白超家族(IgSF)成员的胞外区来实现亲细胞性的结合。其中,癌胚抗原(CEA)作为IgSF的重要成员,扮演着细胞间粘附分子的角色。在功能上,CEA不仅参与细胞间的相互作用,还与免疫反应、失巢凋亡耐药性的形成以及肝转移的促进作用密切相关。
2.1细胞间相互作用
细胞间的粘附在与周围细胞及组织结构的通讯过程中起着至关重要的作用。在细胞膜上,CEA作为细胞间粘附分子,能够连接上皮细胞膜及相邻细胞群。CEA通过GPI锚定在细胞膜上,利用其与整合素α5β1(细胞外基质的主要受体)共定位的特性,强化细胞与纤连蛋白的结合能力。
此外,CEA还能通过反向平行的CEA-CEA同种相互作用,或CEA-CEACAM1、CEA-CEACAM6异种相互作用发挥细胞粘附分子功能。这种相互作用依赖于具有可变Ig结构域的N结构域和A3B3结构域。已知CEA特有的A3B3结构域内含有28个由天冬酰胺连接的高度糖基化位点,但这些位点与结构域间的相互作用是否有关尚不明确。
2.2CEA抑制免疫反应
相较于正常组织,肿瘤组织中CEA呈现高表达状态。这种肿瘤特异性糖基化修饰CEA能够与树突状细胞上的特异性细胞间粘附分子——DC-SIGN(树突状细胞特异性ICAM-3抓取非整合素)相互作用,抑制树突状细胞对肿瘤进展相关的特异性免疫反应。
2.3抑制失巢凋亡
除了参与血液循环的细胞,多数细胞都紧贴于组织内部。这种紧密的排列方式为细胞提供了必要的信号传递支持,促进了相邻细胞与细胞外基质(ECM)间的有效交流。当细胞从ECM上脱离时,细胞会丧失正常的细胞-基质间相互作用及极性,进而触发失巢凋亡过程,这是一种因锚定依赖性细胞脱离(环境或ECM)而引发的细胞死亡现象。在肿瘤转移过程中,肿瘤细胞能够抵抗失巢凋亡介导的死亡,并在血管系统中存活。
失巢凋亡介导的细胞死亡与整合素介导的细胞粘附信号缺失之间存在着密切的关系。细胞表面的CEA通过激活整合素信号通路,破坏组织结构,抑制细胞分化和失巢凋亡。从ECM上脱落的细胞会产生肿瘤坏死因子(TNF)相关的凋亡诱导配体(TRAIL)、TRAIL-R2配体以及死亡受体5(DR5)。以DR5为例,它在结肠癌细胞系的失巢凋亡过程中发挥着关键作用。循环肿瘤细胞表面的CEA能够直接与DR5结合,从而抑制DR5介导的下游死亡信号传递,使癌细胞得以逃避失巢凋亡的命运。此外,细胞表面的CEA还能与转化生长因子β(TGF-β)I型受体(TβRI)发生直接相互作用,进而改变下游的TGF-β信号通路,促进肿瘤细胞的增殖。
2.4促进癌细胞转移
在结直肠癌转移机制的研究中,科学家们观察到循环肿瘤细胞在迁移过程中会与组织内的巨噬细胞相遇。巨噬细胞源自单核细胞的分化,它们与单核细胞一样,具备吞噬和清除细胞残骸及病原体的功能,维护组织稳态,使组织免受外界刺激或损伤。此外,巨噬细胞还能激活淋巴细胞及其他免疫细胞对病原体的免疫反应。
位于肝窦内的Kupffer细胞,是肝脏中的一种特殊巨噬细胞。当结直肠癌细胞释放的CEA(癌胚抗原)水平上升时,会触发Kupffer细胞的活化。CEA能够与Kupffer细胞表面的hnRNP M4分子结合,激活Kupffer细胞,诱导其过度表达细胞因子。这些细胞因子的释放会改变肝脏微环境,使循环结直肠癌细胞得以在肝脏中存活,促进癌细胞转移。
除了Kupffer细胞外,其他终末分化巨噬细胞(例如肺泡巨噬细胞)以及某些癌细胞表面也会表达hnRNP M4。hnRNP M4在细胞内主要参与mRNA的加工、选择性剪接、microRNA的生物合成以及mRNA从细胞核到细胞质的转运等过程。然而,当hnRNP M4作为CEA受体时,它在Kupffer细胞和肺泡巨噬细胞中则展现出独特的功能。
结直肠癌细胞的肝或肺转移,通常始于CEA与Kupffer细胞表面hnRNP M4的结合。尽管目前关于CEA影响癌细胞转移的具体机制尚不明确,但这一发现无疑为结直肠癌的治疗提供了新思路。
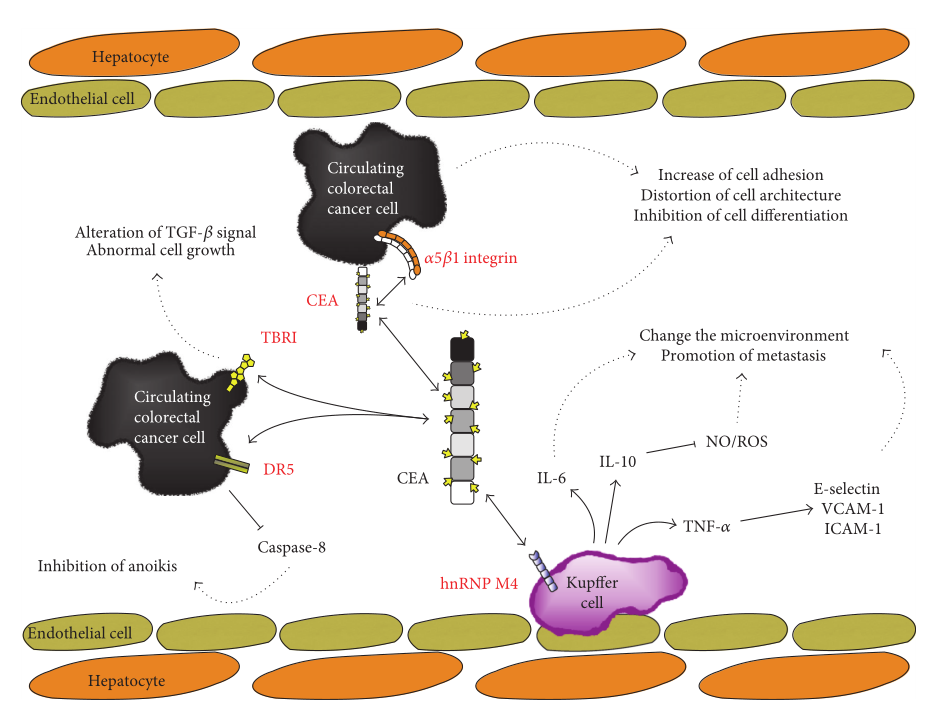
图3.影响CEA的生物事件示意图
注:红色字母表示的是与CEA直接相互作用的分子。虚线箭头表示影响CEA的生物事件结果。在循环结直肠癌细胞中,CEA与DR5的相互作用导致caspase-8活性下调,诱导失巢凋亡抑制;CEA与TBRI的相互作用会干扰TGF -β信号通路,促使癌细胞异常增殖。此外,CEA还可以与Kupffer细胞上的hnRNP M4发生相互作用,促使Kupffer细胞分泌一系列细胞因子,如IL-6、IL-10和TNF-α。这些细胞因子会使肝脏微环境转变为有利于肿瘤转移的状态,从而促进原发性肿瘤细胞的有效转移。
参考文献
[1]Ibrahim MR, Greish YE. MOF-Based Biosensors for the Detection of Carcinoembryonic Antigen: A Concise Review. Molecules[J]. 2023,28(16):5970.
[2]Lee JH, Lee SW. The Roles of Carcinoembryonic Antigen in Liver Metastasis and Therapeutic Approaches. Gastroenterol Res Pract[J]. 2017,2017,7521987.
[3]Zid M, Drouin G. Gene conversions are under purifying selection in the carcinoembryonic antigen immunoglobulin gene families of primates[J]. Genomics, 2013,102(4):301-9.
[4]Taheri M, Saragovi U, Fuks A, et al. Self recognition in the Ig superfamily. Identification of precise subdomains in carcinoembryonic antigen required for intercellular adhesion[J].J Biol Chem,2000,275(35):26935-43.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302