甲胎蛋白(AFP)的结构功能、异质性及配体
甲胎蛋白(AFP)是胚胎血浆中的一种主要大型糖蛋白,属于白蛋白样蛋白家族,分子量约为68kDa,由包含590个氨基酸残基的单多肽链组成。甲胎蛋白由卵黄囊和胎儿肝脏产生。在妊娠12周左右,卵黄囊退化,胎儿肝脏成为AFP合成的主要部位。该蛋白在胎儿体内的浓度很高(1-10mg/mL),但在出生后不久便急剧下降,到产后第二个月末,仅能检出微量的AFP,几乎完全被血清白蛋白所取代。妊娠期间甲胎蛋白含量的变化可用于胎儿异常的检测,包括唐氏综合征和神经管开放性缺陷,如脊柱裂。成人血浆中甲胎蛋白含量的显著增加是肝细胞癌和卵黄囊瘤等几种病理状况发展的标志。
1.AFP的功能
AFP具有多种生物活性,主要包括细胞外转运功能。它能与雌激素相互作用,对脂肪酸和胆红素具有高亲和力,并能有效结合Cu2+和Ni2+离子。此外,AFP还参与调节细胞增殖和代谢,与微噬细胞、T淋巴细胞相互作用,抑制母体对胚胎的免疫反应和患者对肿瘤的免疫反应。
2.AFP的结构
2.1AFP的分子形状
从非晶体状态下的原始空间结构来看,AFP分子成V型不对称结构,含有三个不同的结构域。分子左下“臂”结构域之间存在多肽连接,这种多肽连接可能充当“铰链”,允许结构域的灵活移动,并促进潜在配体的结合或释放。
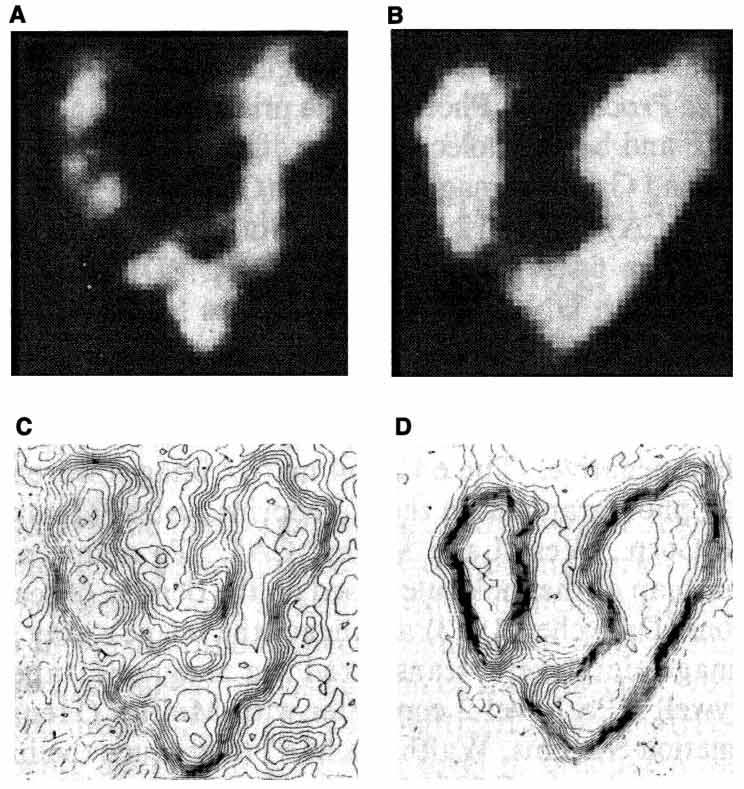
图1.AFP的空间结构
注:电子显微镜分析人类AFP(A)和牛AFP(B)的空间结构。(C,D)为人和牛AFP的反质图。
2.2AFP的结构域
AFP由3个结构域组成,分别为I、II和III,每个结构域由大约195个氨基酸残基组成。AFP分子的末端部分(总共有420个氨基酸残基)被折叠成稳定的独立结构域,即N端结构域I和C端结构域III,而AFP的中心结构域(由170个氨基酸残基组成的结构域II)具有高度的灵活性,容易被胃蛋白酶消化。研究表明,结构域III的氨基酸序列最保守,结构域I的氨基酸序列最不保守。
2.3AFP的分子结构
近紫外CD光谱强度反映了芳香氨基酸残基结构中的不对称程度,表征了蛋白质三级结构。紫外光谱强度的降低通常用于表征蛋白质变性过程中三级结构变化。天然AFP三级结构为相对刚性的不对称结构。不同样品中AFP的结构特性差异较大,降低pH值,加热或加入尿素会导致AFP刚性三级结构变化,如pH3.0,或90℃,或9.5M尿素(图2A);配体释放也会引起AFP三级结构变化,且释放天然配体后AFP三级结构几乎没有差异(图2)。与三级结构不同,AFP二级结构几乎不受配体含量、配体释放、以及溶液酸化的影响。
差示扫描微量热法(DSC)显示,AFP变性是一个不可逆的过程,这可能是由于蛋白质变性过程中不可逆的配体释放所致(图3A曲线3)。配体组成的差异(由于分离程序的不同)可能会极大地影响蛋白质的量热行为,不同样品中AFP的稳定性和三级结构都存在配体驱动差异(图3B)。不同纯化程序导致配体释放,AFP三级结构发生改变(图3B),在某种程度上不同的天然配体含量,可能因分离程序不同而存在差异。蔗糖是AFP的天然配体之一,在蔗糖存在的情况下,熔化过程更为复杂(图3C),这表明配体可能在AFP空间结构稳定中起着至关重要的作用。

图2.AFP的近紫外CD光谱
注:(A)不同实验条件下,金属亲和纯化AFP的近紫外CD光谱,1、pH7.0、23℃;2、pH3.0, 23℃;3、pH7.0,90℃;4、pH7.0,尿素9.5M。(B)天然配体对甲胎蛋白刚性三级结构的影响。图中为通过金属亲和(1)或不同的免疫亲和方法(3和4)从人脐带血清中分离出的蛋白的近紫外CD光谱。图中也显示了无配体(2)和完全未折叠蛋白(5)的光谱以供比较。
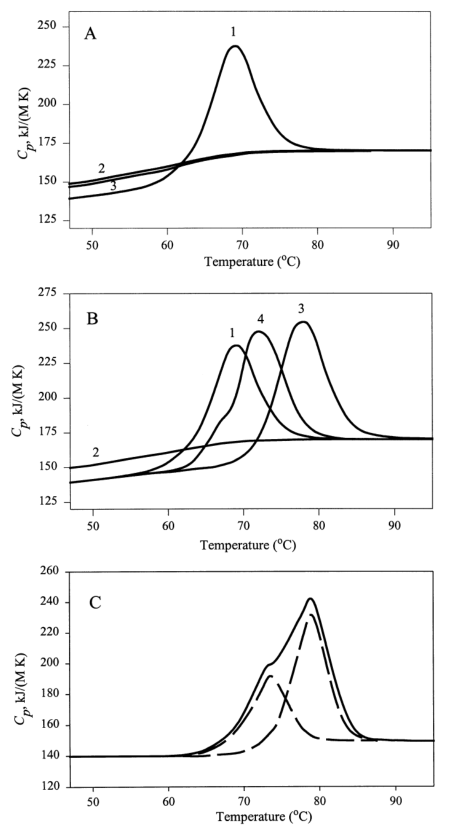
图3.AFP偏摩尔热容的温度依赖性
注:(A)为不同实验条件下金属亲和层析分离蛋白的量热曲线:1、pH7.0;2、pH3.0;3、在pH7.0下对蛋白质进行重复温度扫描的结果。(B)为用金属亲和法(1)或两种不同的免疫亲和法(3和4)从人脐带血清中分离的AFP样品测得的量热曲线,也显示了无配体形式的熔化(2)。(C)金属亲和纯化的AFP在0.2%蔗糖存在下的熔化,虚线表示由量热曲线分解引起的两个简单转变。
2.4AFP的构象稳定性
众所周知,尽管蛋白质具有广泛的结构空间,但它具有严格的构象,在溶液中可以存在多种稳定的有序构象,在一定条件下,多肽链可以由有序构象变为无序构象,反之亦然。这种构象转变是对外部条件(如温度、pH值或溶剂组成)变化的反应。
对于AFP来说,即使是a.在pH4.5~10.5范围内;b.尿素浓度低于7.5 M(pH7.5);c.盐酸胍浓度低于2.0M(pH7.5)时,仍然具有较高的构象稳定性。AFP具有极高的构象稳定性很可能是由于大量的二硫键(15个),天然配体显著增加了AFP的稳定性。
2.5AFP变性的不可逆性
研究中显示,任何一种AFP变性(由pH值降低或温度升高引起,或由尿素、GdmCl变性引起)都是不可逆的,这种不可逆性是由不可挽回的配体释放引起的。无配体的AFP具有致密的二级结构,但没有刚性三级结构。
造成AFP重折叠和配体释放的不可逆性原因可能有两种。第一种,形成结构的配体结合位点和碳水化合物(糖基化修饰)的附着位点,在空间上相对较近。在这种情况下,AFP的寡糖成分可能起到帽子的作用,调节配体进出蛋白质分子的运动(图4A)。在天然状态下,配体结合在AFP的疏水性口袋内,并且“门被糖部分锁定”(图4A-1)。在轻度变性条件下,配体可以很容易地从蛋白质上去除(图4A-2)。当变性分子恢复到生理条件时,它开始折叠,碳水化合物与AFP的非共价相互作用筛选疏水口袋,阻止配体正常渗透到其结合位点(图4A-3)。
第二种,AFP重折叠和配体释放的不可逆性可能与非天然AFP分子的自结合有关(图4B)。蛋白质重折叠常伴有部分折叠的中间体短暂结合。结合或聚集倾向是非天然蛋白质的一般性质,即使在天然状态下,当浓度足够高(0.5-1.0mg/mL)时,AFP也倾向于形成二聚体。因此,人们推测部分折叠的AFP分子自结合(甚至是简单的二聚化,如图4B所示)可以筛选配体结合位点,从而阻止配体与AFP的相互作用。目前,这两种可能性还有待进一步研究。
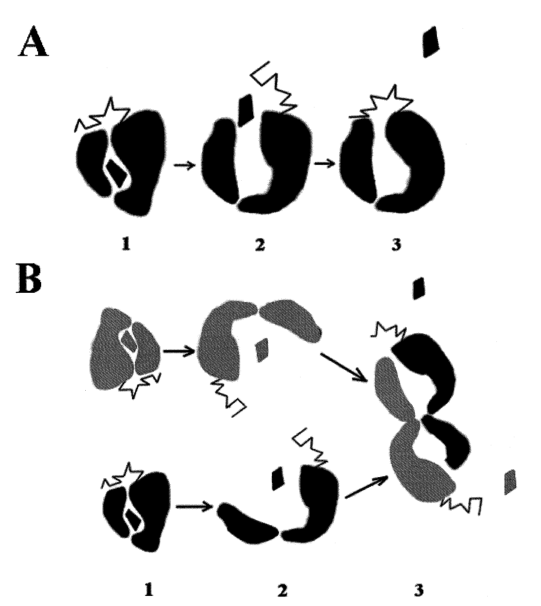
图4.AFP中疏水配体释放不可逆性示意图
注:(A)糖基化、(B)结合决定的不可逆性。
3.AFP的异质性
3.1AFP免疫化学异质性
研究发现AFP分子上有16个不同的表位,根据交叉反应性将这些表位分为5个免疫优势簇(A-E)和7个单表位。AFP在D簇的可接近性上存在差异,具有开放性表位的AFP,D簇与相应的单克隆抗体反应;具有隐性表位的AFP,仅在部分变性后才能与单克隆抗体反应。已知106和108是隐性表位,隐藏表位D、106或108仅在部分AFP分子中表达,106、108和D簇表位的变化,被认为是AFP构象变化的标志。不同来源AFP中D、106表位表达差异很大。研究显示,生殖细胞肿瘤患者的血清和肝细胞癌患者的血清中AFP倾向于D-和106-表位形式,羊水AFP倾向于D+和106+形式。
不同构象的AFP具有相同的分子质量和相互转换的特征。蔗糖可以稳定AFP的天然状态,将D+、106+和108+形式的AFP分子几乎完全转化为D-、106-和108-变体。在0.2%蔗糖条件下,D+和106+可以转化为D-和106-。硝基纤维素或塑料吸收AFP,而D-在硝化纤维素上固定后可以转化为D+,另外添加45%甲醇可增强表位D、106和108的表达。
3.2AFP电荷异质性
不同方法分离的AFP样本通常在免疫上是均匀的,但总存在电荷非均质性。在pH值4.5-5.2范围内,使用等电聚焦法则发现了9种AFP变体。从人羊水或脐带血中分离出7种不同电荷形式的AFP,而从不同肝癌来源分离的AFP比从胎儿组织或羊水分离的AFP表现出更多的电荷异质性,此外,新鲜人类肝癌AFP样品在储存过程中电荷异质性会增加。
这导致电荷异质性的原因可能有三种:氨基酸序列的差异、糖基化或配体结合。同一物种AFP的电荷异质性与氨基酸组成的差异无关。蛋白质碳水化合物成分的差异只能解释部分电荷差异,因为用神经氨酸酶处理AFP可以消除部分异质性,因此同一物种中AFP电荷异质性主要与配体结合有关。从人胎儿组织中分离的AFP含有两种成分,其等电点分别为4.7和5.3。等电点的值取决于天然配体(脂肪酸)的含量,pI4.7的AFP结合脂肪酸,pI5.3成分未结合脂肪。通过去除脂肪酸,这些异质AFP分离物可以转化为基本均匀的物质(pI为5.3)。在非变性条件下,制备的AFP存在多种组分,但在SDS凝胶电泳中AFP通常显示为单带。
4.AFP与配体
4.1AFP的配体运输和释放
AFP与细胞膜相互作用,由于局部pH值和有效介电常数的降低,细胞膜环境可能发生变性。这意味着当AFP与膜表面相互作用时,可能发生某些蛋白质的变性。这种由膜诱导的蛋白质转化为熔融球状状态具有重要的功能,促进了跨膜蛋白质运输和毒素渗透到细胞中。
熔融球状中间态,是一种致密中间体,它们没有刚性的三级结构,但具有类似原生的二级结构。刚性天然蛋白分子向熔融球体的结构转变,可以增加灵活性,促进疏水配体的释放。研究表明,与破坏AFP刚性三级结构的条件不同,要想AFP二级结构重排,致密性发生改变,需要更高浓度的有机溶剂(如甲醇、三氟乙醇)。
4.2配体对AFP结构的影响
配体在维持AFP的刚性空间结构中起着至关重要的作用。在无配体形式下,该蛋白呈现熔融的球状构象,显示出紧凑的天然二级结构与缺乏独特的三维结构组合。熔融球态的模型是一种“半刚性”分子,它保留了天然折叠模式的主要特征,但具有更大的内部运动,包括许多内部侧链的旋转异构化。这些特性对于活细胞蛋白质在细胞质、细胞器或膜(疏水)环境中调整自身以适应不同的条件是很有利的。
4.3配体对AFP功能的影响
AFP的空间结构和稳定性对天然配体的存在高度敏感。如前所述,AFP至少有两种功能,运输和免疫调节。由于该蛋白具有严格的结构与功能关系,因此认为该蛋白的功能也可能受到配体的调节。关于AFP的主要配体仍有很大争议,例如肝癌来源的AFP配体(一种特定脂肪酸)的类型和数量都有很大的变化。
配体释放介导的AFP分子从天然状态向熔融球状状态的不可逆构像转变,可能代表了AFP从无活性形式到活性(免疫抑制)形式的转变,这种转变对免疫调节功能至关重要。
此外,AFP的体外免疫抑制特性差异很大,而这种变化并不是由糖基化程度引起的,因为同一来源的AFP变体碳水化合物含量没有显著差异。研究发现,低pH值或高离子强度可以影响AFP生物效力,纯化过程可能会使AFP变性,发生不可逆构象转变,影响其免疫调节活性。
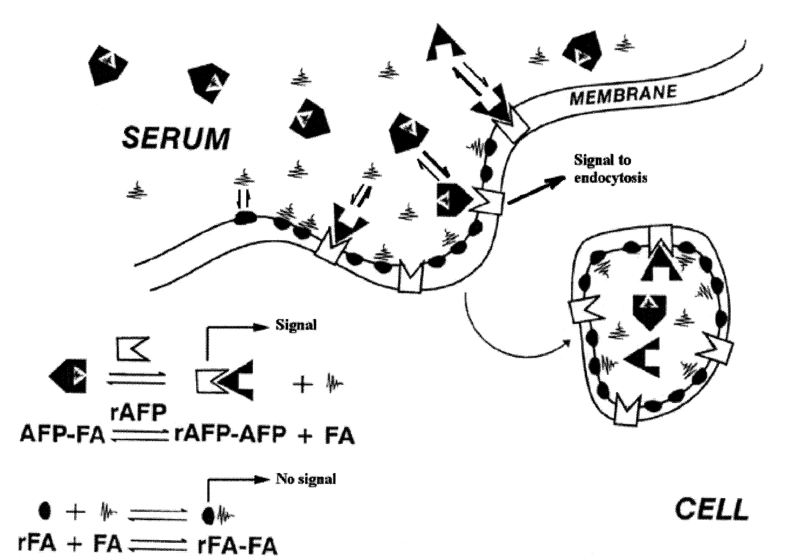
图5.AFP配体饱和形式转化为无配体形式示意图
注:图5代表了AFP内吞作用和脂肪酸向靶细胞转移的双受体模型。该模型是基于不同细胞对AFP和脂肪酸(FA)摄取的大量研究提出的。根据该模型,细胞表面有两种不同的受体(AFP-和FA-结合位点)。配体饱和的AFP与相应的受体结合产生内吞作用信号。另一方面,AFP与受体的相互作用使蛋白分子进入膜表面轻度变性环境,蛋白质的构象发生变化,伴随AFP-FA复合物解离。随后FA被转移,与附近的FA受体结合。无配体的AFP可以与AFP受体分离,也可以通过内吞作用与脂肪酸一起转移到细胞中。这种无配体的熔融球状AFP可以作为免疫调节剂。
参考文献
Gillespie JR, Uversky VN. Structure and function of alpha-fetoprotein: a biophysical overview. Biochim Biophys Acta[J]. 2000,1480(1-2):41-56.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302