甲胎蛋白(AFP)的糖基化及配体结合
甲胎蛋白(AFP)是一种69 kDa的胎儿血清糖蛋白,主要在胎儿肝脏和卵黄囊中合成,半衰期为4-5天。除了妊娠期AFP水平较高外,肝癌患者血浆中AFP浓度也较高,被公认为最早发现的肿瘤标志物之一。越来越多的证据表明AFP在肝细胞癌(HCC)的发生发展中起着重要的生物学作用。AFP促进HCC细胞增殖、侵袭和转移,抑制细胞凋亡,增强干性基因的表达。这些恶性功能是通过cAMP-PKA、RA-RAR、Caspase3、PTEN、PI3K/AKT/mTOR等信号通路激活或抑制下游靶基因表达而实现的。AFP还具有免疫抑制功能,例如,AFP抑制DC线粒体代谢,诱导DC凋亡,增强NK细胞的细胞毒性,改变CD4+/CD8+ T细胞的比例,从而抑制T细胞介导的细胞毒性。此外,AFP影响巨噬细胞分化和吞噬活性。AFP通过参与免疫调节,促进HCC细胞的免疫逃逸。
1. AFP的糖基化特征
AFP的糖蛋白变异最初是用神经氨酸酶和刀豆蛋白A鉴定和分离的。随后通过各种凝集素确定了甲胎蛋白中的糖链类型,并发现妊娠和肿瘤发生期间甲胎蛋白的聚糖组成不同。1990年,研究人员利用氢核磁共振(1H-NMR)技术成功鉴定了AFP糖肽结构。质谱和相关技术的进步促进了AFP糖肽类型的有效鉴定,促进了AFP作为肿瘤标志物的发展。
1.1 AFP的糖基化修饰位点
N链糖基化是一种共翻译或翻译后修饰,其中糖链连接到特定的天冬酰胺残基上,具有一致的氨基酸序列N-X-S/T,其中X代表除脯氨酸以外的氨基酸。研究人员在AFP的Asn251中检测到一个额外的电子密度图。AFP中N251周围的氨基酸序列为TKVNFTEIQ,符合N-链糖基化标准,因此推测这种密度就是糖链结构。SDS-PAGE分析观察到AFP丝氨酸(N251S)突变成天冬酰胺后具有更高的电泳迁移率(图1b),表明该突变导致糖基化丧失,降低了AFP的分子量,这进一步证实了该密度为糖基化修饰。
1.2 天然与肿瘤源性AFP的糖基化差异
对正常HEK 293F细胞和肝癌细胞Bel7042提取的AFP(293-AFP和7402-AFP)进行糖基化质谱分析。结果表明,AFP在残基N251上的N链糖基化组成不同。两种细胞系AFP的多糖组成均含有浓缩多糖,浓缩多糖的比例均超过总多糖的75%。这表明来自两种细胞系的AFP都倾向于AFP-L3,AFP-L3的特点是在其聚糖链的N-乙酰氨基葡萄糖还原端有一个α-1,6-聚焦残基。两种细胞系来源的AFP主要聚糖组成不同,293-AFP的主要聚糖组成为HexNAc(5)Hex(4)Fuc(1),占26.82%,而7402-AFP的主要聚糖组成为HexNAc(4)Hex(5)Fuc(1),占44.44%。
肿瘤源性AFP(tAFP)和脐带天然AFP(nAFP)糖基化的主要区别在于核心多糖是否与岩藻糖残基相连,nAFP通常缺乏岩藻糖残基,但也有特例。AFP聚糖组成的差异可能最终导致功能差异,例如肿瘤源性AFP(tAFP)可直接诱导NK细胞和DC细胞凋亡。
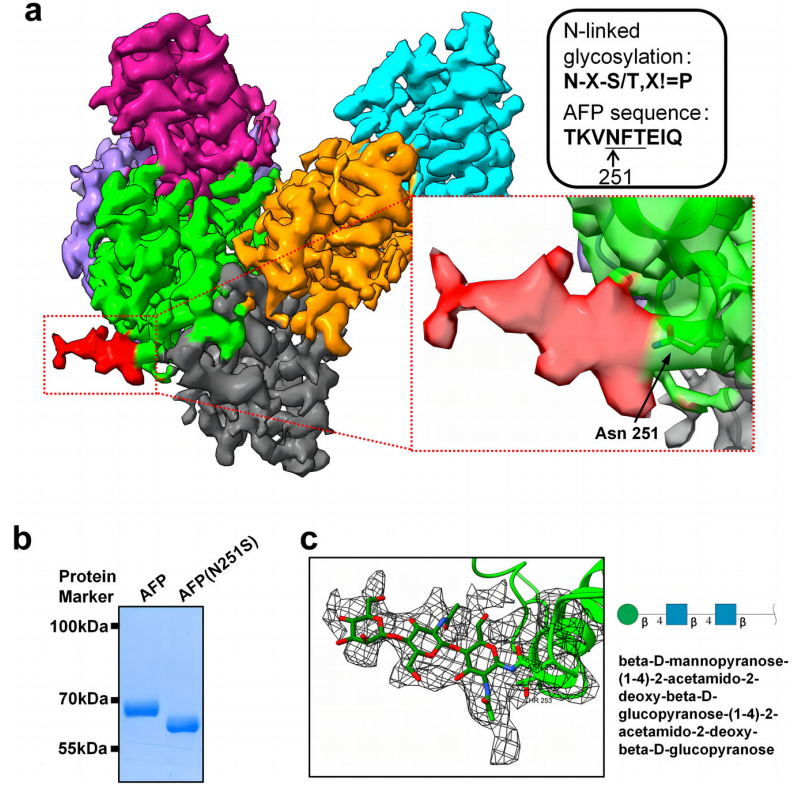
图1. AFP的N-糖基化
注:a.一个连接到AFP Asn251的附加电子密度图。密度图根据AFP子域进行颜色编码,额外电子密度图用红色标记。AFP序列符合N链糖基化序列模式。b. AFP和突变AFP(N251S)的SDS-PAGE分析。c. AFP的寡糖结构。这种低聚糖被称为β-D-甘露吡喃糖-(1-4)-2-乙酰氨基葡萄糖-2-脱氧-β-D-葡萄糖吡喃糖-(1-4)-2-乙酰氨基葡萄糖- 2-脱氧-β-D葡萄糖吡喃糖。
2. AFP的金属离子结合
2.1 金属离子结合位点
金属离子通过参与氧化还原反应、电子转移、酶催化和蛋白质结构稳定等各种过程,在生物系统中发挥着至关重要的作用。研究人员在AFP IA结构域中,发现了一个金属离子结合位点,涉及四个氨基酸His22、His264、His268和Asp280(图4a)。有趣的是,金属离子并非在蛋白质提取过程中引入的,电子密度图表明在培养基中就存在AFP与金属离子的结合。
将AFP的4个氨基酸突变为丙氨酸,得到突变体AFP-4mut(H22A、H264A、H268A和D280A)。在此之后,使用电感耦合等离子体质谱(ICP-MS)评估金属离子与野生型AFP和突变型AFP-4mut蛋白的结合。结果表明,突变体AFP-4mut中金属与蛋白质的摩尔比降低,特别是镁、铝、镍和锌等元素(图2a)。这意味着AFP中鉴定的四种氨基酸具有结合不同类型金属离子的能力。
2.2 AFP的金属离子结合模式
研究发现,在AFP的结构中有一种有趣的金属离子结合模式,这与Cu、Zn-SOD(PDB:5K02)中观察到的一致(图2)。AFP与Cu,Zn-超氧化物歧化酶 (Cu,Zn-SOD) 在结合铜离子和显示超氧化物歧化酶活性的能力方面具有相似之处。这表明AFP具有多种功能,不仅促进金属离子传输,而且还可能与调节血液中氧化还原反应的平衡有关。
此外,一些金属元素与AFP的摩尔比超过1,这表明AFP可能在多个位置与金属离子结合。选择Zn2+拟合到密度图中(图3a),发现它与His22、His264、His268和Asp280呈四面体配位(图2b)。通过CheckMyMetal服务器分析键长和金属配位(图2c),锌离子到3个氮原子和1个氧原子的平均距离分别为2.35 Å和2.45 Å。一些参数,如Valence和nVECSUM不理想,可能是由于在该结合位点结合多个金属离子。该基序为AFP提供了很强的金属离子结合能力。His22与Zn2+的配位进一步稳定了AFP的N端环结构。胎生动物和卵生动物AFP的金属离子结合基序,在序列保守性上存在差异(图3c)。这表明AFP在金属离子结合中的功能作用存在潜在的进化差异。
先前的研究表明,AFP对Zn2+ 的亲和力高于人血清白蛋白(HSA),这可归因于结构差异,包括存在参与结合的额外组氨酸残基。甲胎蛋白是妊娠期间的主要运输载体。与HSA相比,AFP对金属离子具有高亲和力的一种可能解释是它需要穿过胚胎-胎儿屏障。此外,从进化的角度来看,AFP的金属离子结合基序在胎生动物中表现出更大的保守性(图3c)。与卵生动物相比,胎生动物的胎儿需要穿过胎盘屏障才能从母体获取必需的营养物质,因此需要更强的亲和力。
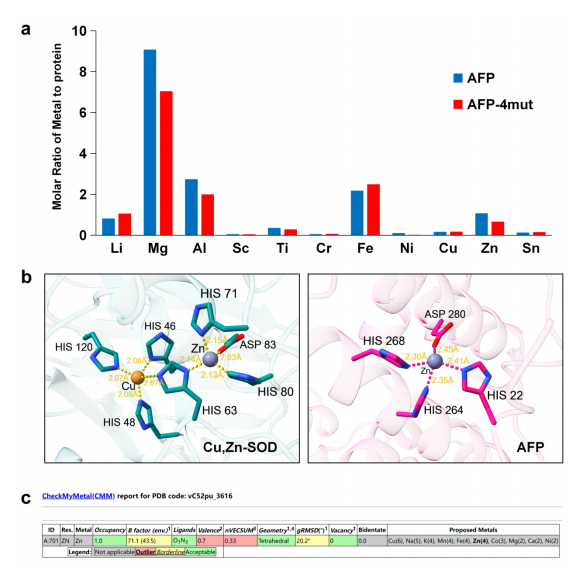
图2.金属离子含量检测及结构验证
注:a.用ICP-MS测定AFP中金属的含量。直方图的横轴表示金属元素。一些含量较低或添加的元素不显示。纵轴表示金属与蛋白质的摩尔比。AFP-4mut表示四种突变:H22A、H264A、H268A、D280A。AFP-4mut与金属的摩尔比减小表明金属与AFP结合。b.描绘Cu、Zn-SOD(5K02,深青色)和AFP(8X1N,粉色)中金属离子结合位点的原子模型。黄色虚线表示离子到残留物的距离。c. CheckMyMetal服务器验证AFP-Zn2+。网站地址:https://cmm.minorlab.org/,PDB代码:8X1N。
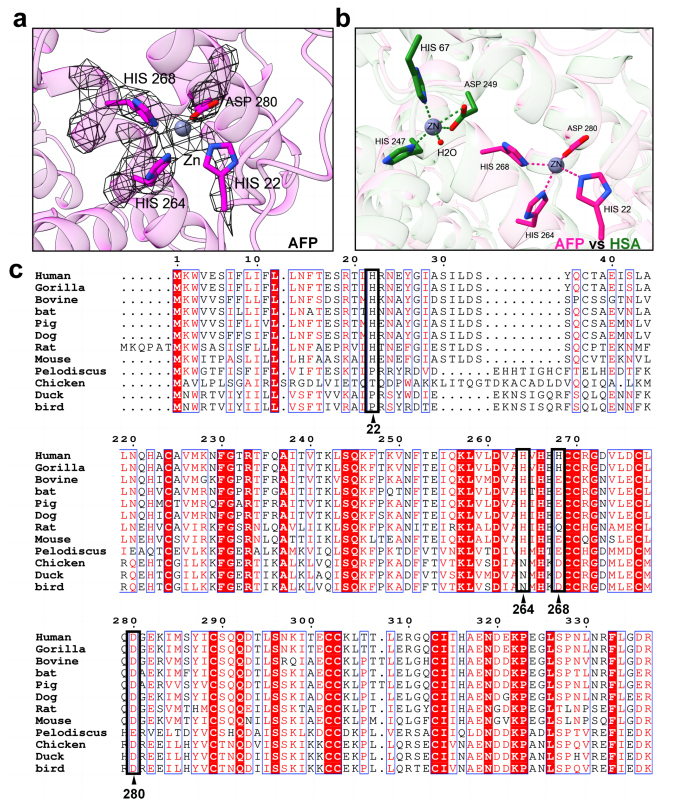
图3.AFP金属离子结合位点分析
注:a.甲胎蛋白Zn2+和Zn2+结合位点的原子模型和低温电镜密度。Zn2+结合残基用洋红色棒状表示,Zn2+用灰色球状表示。密度用黑色网格表示。b. AFP与HSA中Zn2+结合位点的结构比较。AFP(洋红色)和HSA-Zn2+配合物(5IJF,绿黄色)重叠,结构域I对齐。锌离子为灰色,氧为红色,氮为深蓝色。金属离子结合位点用黑色三角形表示。不变残基和高度保守残基分别用红色阴影和红色字母表示。
3. AFP与脂肪酸的结合
在AFP模型中,某些区域表现出不同的密度图,表明是独立结合的配体,初步推测这些是AFP的天然结合脂肪酸。GC-MS结果表明,与AFP结合的FA中,棕榈酸(C16:0)含量最多(图4a),占总FA的57.42%。棕榈酸的大小与这些密度一致(图4b)。
3.1 AFP的FA结合位点
FA结合位点分别位于AFP亚结构IIA、IIA/IIB、IIIA和IIIB,根据氨基酸序列顺序命名为FA结合位点-1/2/3/4。FA在结合位点1处,与AFP的IIA亚结构相互作用。与FA的相互作用主要涉及5个螺旋氨基酸残基,FA链多被疏水性氨基酸包围。FA羧基的取向由带正电的极性氨基酸Lys242和Lys246决定,而His266和Met285则有助于形成s形FA构象。FA结合位点-2位于AFP亚结构IIA和IIB之间的界面,位于由四个α螺旋形成的浅槽内。三个氨基酸残基Arg233、Asn348和Gln378作为锚点将FA固定在这个结合位点上。在FA结合位点3处,FA呈U型弯曲,完全占据AFP亚结构IIIA内的结合袋。在FA下方,Glu474与Arg372、Ser408和Arg500之间形成氢键,与其他氨基酸形成半封闭的口袋,这可能是导致FA链不能向下延伸的原因。FA的羧酸基团可能与Tyr435、Lys438和Ser513残基相互作用。FA结合位点-4由横跨子结构域IIIB的疏水通道形成。FA在袋内呈线性延伸。一些极性氨基酸,包括Tyr425、Tyr426、Asn429和Lys549决定了FA羧基的位置。
3.2 AFP的结合特性
AFP的疏水性分析表明,蛋白质的整体外表面是亲水的,有利于其存在于血液中。相反,FA结合口袋为疏水表面,使其适合与疏水分子(如FA)相互作用(图5a)。此外,AFP表面的负电荷比例较高,这有助于其较低的等电点。值得注意的是,大多数带正电的氨基酸侧链位于FA结合口袋的入口,特别是精氨酸和赖氨酸,可能有助于锚定带负电荷的FA羧基(图5b)。
此外,使用NanoTemper Tycho NT.6测试蛋白质的热稳定性,发现脱脂AFP的热稳定性下降。然而,重新引入FA后,其恢复原有的热稳定性(图4c),说明FA的结合促进了AFP的热稳定性。
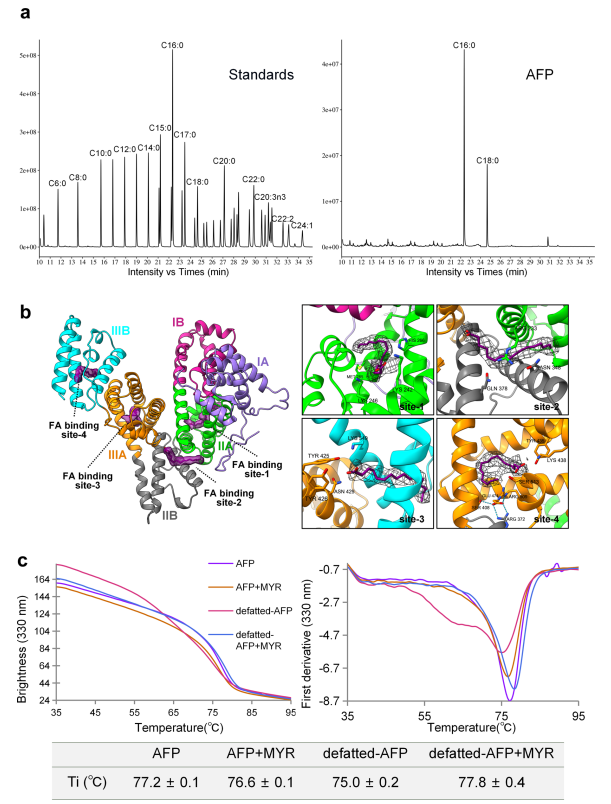
图4.AFP的脂肪酸结合位点
注:a.AFP中脂肪酸的GC-MS分析。左图显示脂肪酸标准品的色谱图。右图为从AFP中提取的脂肪酸色谱图,主要峰为棕榈酸(C16:0)和硬脂酸(C18:0)。所有离子均经串联质谱确认。b.AFP中脂肪酸(FA)结合位点的整体和细节特征。左图显示了FA在AFP结构中的密度图和原子结构的空间定位。右图标注了与FA相关的氨基酸。FA是棕榈酸(C16:0),呈紫色。c.采用无标记热移法检测AFP的热稳定性。左图是在没有和存在给定肉豆蔻酸(MYR)的情况下,通过330 nm荧光发射得到的甲胎蛋白和脱脂甲胎蛋白的熔化曲线,右图是这些痕量的一阶导数。弯曲温度(Ti)表示为三个独立测量的平均值±SE。
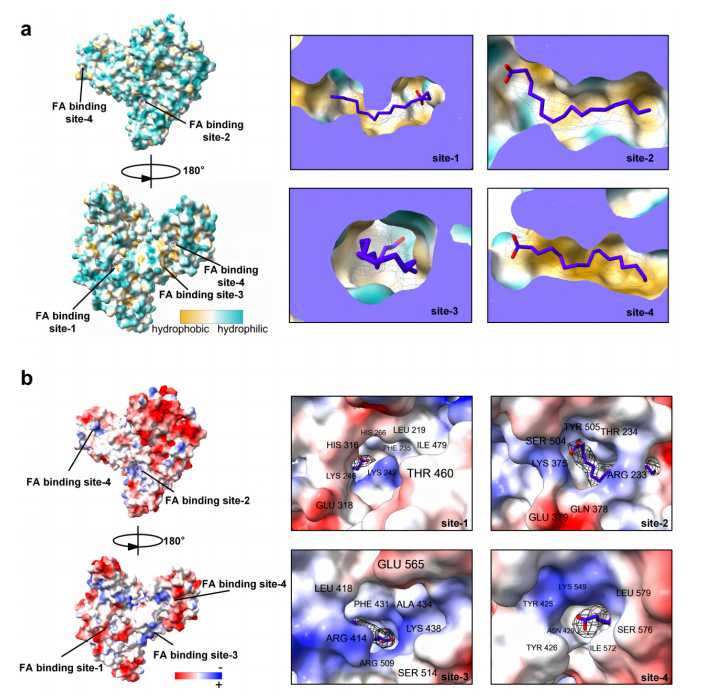
图5.AFP的疏水性和静电势面分析
注:a. AFP中脂肪酸结合袋的疏水性。b. AFP显示在平面图中,并根据其库仑势着色。位于脂肪酸结合袋入口的氨基酸被标记。
众所周知,甲胎蛋白具有运输功能,能够通过胎盘将某些营养物质(FA和金属离子)从母体血液运输到胚胎细胞。研究团队分析了AFP与天然FA结合的结构特征。AFP的FA结合袋不但可以结合FA,也可能与其他小分子配体结合。体内正常细胞通常没有AFP受体,胚胎细胞、肿瘤细胞(HCC、乳腺癌、胃癌等)、增殖的肝细胞和一些免疫细胞(如髓源性抑制细胞)等细胞表面具有特异性AFP受体,它们通过其受体介导的细胞内吞作用消耗AFP。因此,AFP可以作为转运载体将药物靶向转运到肿瘤部位,而不会损伤正常细胞。计算机辅助对接技术可用于筛选对AFP结合口袋具有高亲和力的药物,通过利用AFP肿瘤靶向特性为癌症治疗带来潜在的新策略。
参考文献
Liu K, Wu C, Zhu M, et al. Structural characteristics of alpha-fetoprotein, including N-glycosylation, metal ion and fatty acid binding sites[J]. Commun Biol, 2024,7(1):505.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302