甲胎蛋白(AFP)与人血清白蛋白的结构对比分析
目前对AFP的研究主要集中在其作为肿瘤/妊娠标志物的作用及其细胞生物学功能,而对AFP蛋白结构和性质的研究近年来较少关注。对甲胎蛋白结构的直接观察始于1983年,Luft等人将暗场电子显微镜与激光辅助光学系统相结合,获得了人甲胎蛋白分子的“V”形图像。圆二色、荧光光谱、扫描微量热等技术已被用于研究AFP的二级结构和构象,以及其蛋白质性质,如稳定性和配体结合。Vladimir N. Uversky的实验结果表明,AFP在各种条件下(如pH 4.5-10.5;低于70℃;低于2.0 M盐酸胍或7.5 M尿素)具有很高的蛋白质稳定性。虽然AFP的三维模型已经被模拟和利用,但AFP的真实构象仍然难以捉摸。
研究人员利用HEK 293F细胞系制备了重组AFP,并利用单粒子冷冻电镜(cryo-EM)成功地鉴定了其结构;详细分析了其结构特征,并与人血清白蛋白(HSA)进行了系统比较。
1. AFP结构分析
为了研究AFP的结构特征,研究人员通过HEK 293F悬浮细胞瞬时表达C端带有2x Strep标签的重组AFP。通过Western blotting确定获得的蛋白为AFP蛋白(图1c),尺寸排阻色谱和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)检测结果显示重组AFP纯度较高(图1a,b),瞬时表达获得的重组AFP蛋白可用于冷冻电镜分析。
研究人员使用cryo-SPARC录制和处理了不同状态的AFP视频(图2a,b)。经过运动校正和对比度传递函数估计,根据0.143的金标准傅立叶壳相关性(图2d和补充图1),以3.31Å的总分辨率生成了cryo-EM图,显示了良好的侧链密度(图2c)。这使得研究人员能够为AFP建立精确的原子模型(图2e)。
AFP具有心脏样不对称形状,尺寸为93.2 Å×83.3 Å×59.6 Å,体积为36030 Å3。在三维结构中观察到全长AFP具有信号肽(残基1-18)和成熟蛋白(残基19-609)。AFP主要由α-螺旋组成,约占其二级结构的69%,α-螺旋由环状区域连接(图2e和图4)。AFP有三个结构域:I、II和III,进一步细分为IA、IB、IIA、IIB、IIIA和IIIB亚结构域。这些亚结构域由4-6个螺旋组成,并产生潜在的配体结合位点(图2e)。
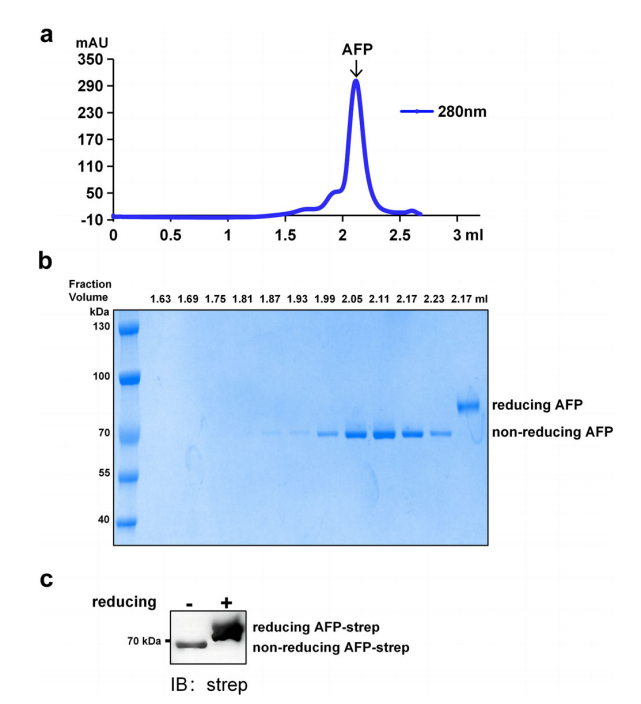
图1.AFP的提取和纯化
注:a.甲胎蛋白的尺寸排阻色谱图,AFP的洗脱峰为单峰,且对称,体积为2.12 mL。b.从尺寸排阻色谱组分中纯化的AFP SDS-PAGE分析结果。当使用含有还原剂β-巯基乙醇的上样液时,还原的AFP分子量约为85 kDa。非还原的AFP分子量约为70 kDa。c.纯化的AFP Western blot分析结果;用Strep抗体进行免疫染色。
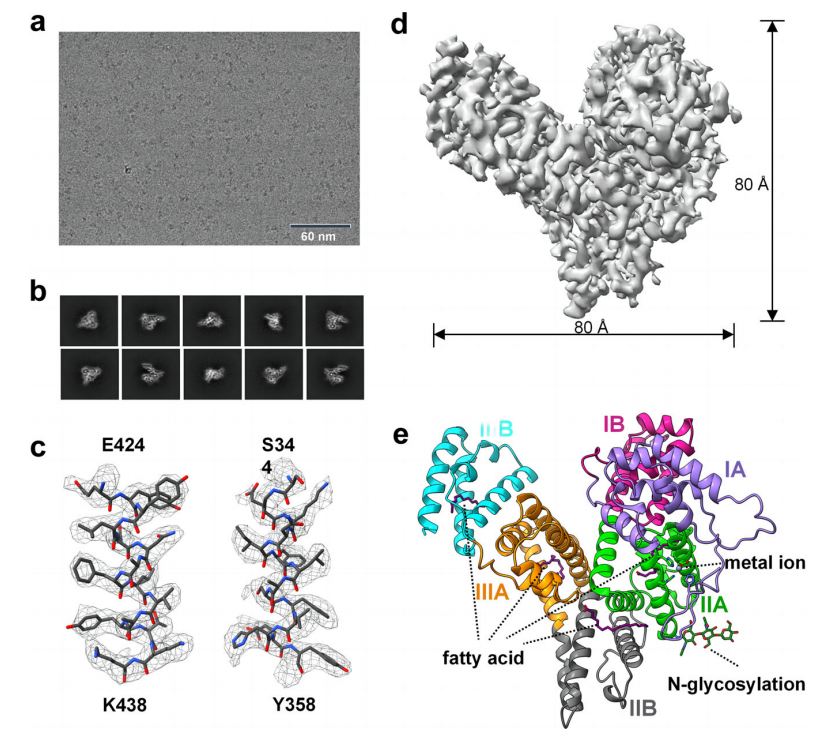
图2.AFP的冷冻电镜分析
注:a.从300kv Titan Krios显微镜上拍摄的冷冻水合AFP的原始显微照片。b.典型的AFP二维平均值。c.密度图对应的AFP原子模型。d.AFP的三维重建图,分辨率为3.31 Å。e. AFP的整体冷冻电镜结构。
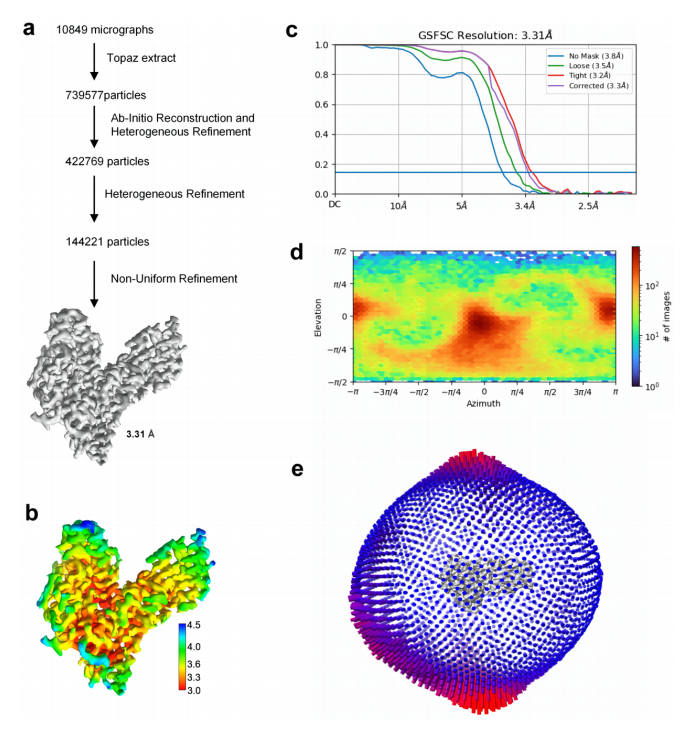
图3.hAFP冷冻电镜分析
注:a.低温电镜数据处理工作流程。b.最终hAFP三维密度图的局部分辨率估计。c.三维细化后的金标准傅里叶壳相关曲线(FSC=0.143)。d.最后一次结构细化迭代中的粒子取向分布。e.欧拉角重构分布。

图4.AFP与HSA序列比对
注:AFP具有代表性的二级结构元素显示在序列上方。不变残基和高度保守残基分别用红色阴影和红色字母表示。参与二硫键形成的胱氨酸残基用同样的绿色数字表示。
2. AFP与HSA的结构比较
人血清白蛋白(HSA)是血浆中含量最多的蛋白质,半衰期为19天。HSA主要在成人肝脏中合成,HSA的功能包括维持血管中的胶体渗透压,调节血液pH值,在炎症条件下作为自由基的清除剂,并参与凝血和伤口愈合等过程。HSA在运输各种生物活性分子,包括蛋白质、FA、激素、药物和营养物质方面也起着至关重要的作用。这些功能取决于HSA的结构特征,其内部结合位点和表面活性基团允许与许多生物分子相互作用并将其运输到全身。由于其血清浓度高、半衰期长、再循环频繁、无毒、无免疫原性等优点,HSA被广泛用作各种治疗分子的递送载体。
AFP和HSA都属于白蛋白家族,在卵黄囊和胎儿肝脏中合成比例较高。在体内,AFP表现出与HSA相似的运输功能,包括将母体营养物质(如二十二碳六烯酸)通过胎盘屏障运输到胎儿,表明其作为药物递送载体的潜力。由于在某些癌细胞中存在特异性的AFP受体,AFP在癌症治疗的靶向药物递送方面比HSA更有潜力。
2.1 整体结构
HSA和AFP的氨基酸序列高度同源,整体结构非常相似。当比较AFP和HSA-棕榈酸(PDB:1E7H)的整体结构时,结构域II几乎完全重叠。HSA和AFP蛋白在249被修剪的原子对之间的RMSD为1.186 Å(所有571对原子间的RMSD为5.763 Å)。与AFP相比,HSA的结构域I更靠近蛋白的中心,亚结构域IIIA/B也更靠近彼此(图5a)。与HSA类似,AFP显示出大量的二硫键,赋予结构稳定性。AFP具有32个半胱氨酸残基,它们都参与了16个二硫键的形成。相比之下,AFP比HSA少3个半胱氨酸残基和1个二硫键。有趣的是,除了第一个二硫键外,其余AFP的二硫键位置与HSA的位置相对应(图5a)。分别比较AFP和HSA的子结构域,发现每个子结构域的构象几乎相同(AFP的N端区域除外)。
2.2 FA结合位点
整体构象差异可能是由配体或底物的结合引起的。比较AFP和HSA的FA结合位点,发现HSA比AFP结合的FA数量更多,并且两种蛋白之间有一些结合位点重叠(图5b)。将AFP的4个FA结合位点与HSA中的相应位置进行比较,AFP的FA结合位点2和4与HSA的FA结合位点6和5在结构上相似。参与FA结合的氨基酸残基的性质也相似。AFP的FA结合位点1与HSA结合位点hsa7相对应。两个FA结合袋具有相似的构象。然而,在HSA IIA和IA之间的界面处存在额外的FA结合,并且FA羧基通过与Tyr150、Arg257和Ser287侧链的氢键锚定在HSA亚结构域IIA中。在AFP中,Arg257和Ser287被非极性氨基酸Gly281和Gly311取代,这使得FA更容易与AFP IIA结合而不是IIA-IA交叉区。AFP的FA结合位点3与HSA结合位点3、4相对应。
2.3 FA结合口袋
两种蛋白结合袋的肽链骨架构象相似,但口袋大小不同。与AFP相比,HSA在亚结构域IIIA中与一个额外的FA结合位点。两种蛋白与FA羧基相互作用的氨基酸残基也不同。在HSA中,FA3与Ser342、Arg348和Arg485形成氢键,而FA4与Arg410、Tyr411和Ser489形成氢键。在AFP中,FA羧基靠近Tyr435和Ser513;Glu474与Arg372、Ser408和Arg509形成氢键,导致Glu474侧链的运动稳定和受限。在HSA中,Pro384与AFP中的Ser408相对应,导致无法与Glu450建立氢键(与AFP中的Glu474相对应)。在FA存在时,HSA的Glu450侧链发生了向外的构象波动。AFP和HSA之间的这种结构差异导致AFP的结合袋尺寸相对较小。因此,FA占据了AFP中大部分的结合口袋,从而阻碍了其结合过量FA的能力。
与HSA不同,AFP的IB亚结构域不与FA结合。HSA与AFP之间参与FA结合的氨基酸性质存在显著差异,如Val141(AFP)与Arg117(HSA)对应,Ala206/207(AFP)与Asp183(HSA)对应。比较这两种蛋白质在亚结构域上的差异,发现环的氨基酸组成发生了变化。与HSA相比,AFP在环中有两个额外的氨基酸。两个带正电的精氨酸残基(Arg114/Arg117)可能在HSA环中起重要作用。在AFP中,这些残基对应非极性氨基酸(Leu138/Val141)(图5c),影响了结合袋的表面电荷和疏水性。因此,环的差异可能是这两种蛋白质在这个口袋中底物结合的决定因素。
2.4 子结构域
对AFP和HSA的所有子结构域进行比较分析,发现两种蛋白之间几乎所有的子结构域都表现出相似的构象。IA亚结构域的构象差异主要集中在N端区域。AFP中的24个N端氨基酸(AA 19-42)形成一个环,其中来自另一个环的Cys37和Cys86形成一个二硫键(图5c),稳定了两个环的构象。此外,AFP的His22与来自IIA结构域的三个氨基酸一起与金属离子形成四面体配位,进一步增强了环结构的稳定性。相比之下,HSA的N端氨基酸形成α螺旋,与其他螺旋一起形成一个小的疏水口袋。HSA FA2链尾部与这个口袋结合,其羧基锚定在结构域IIA上(图5c)。因此,FA与HSA结构域I的结合使得结构域I相对于结构域II旋转,从而促进了连续疏水口袋的形成。这是HSA表现出更紧凑的整体构象的原因之一。
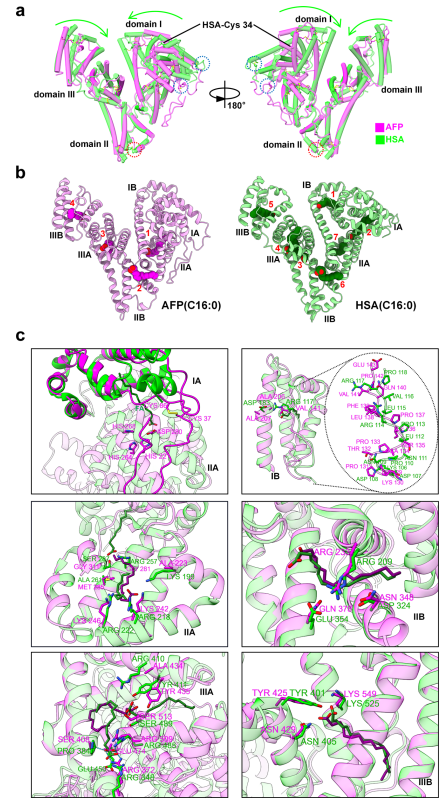
图5.AFP和HSA的整体结构和脂肪酸结合袋比较
注:a.AFP(8X1N,洋红色)和HSA(1E7H,黄绿色)的结构比较。 黄绿色箭头表示HSA相对于AFP偏移的方向。红色虚线圈表示HSA比AFP多出二硫键。蓝色虚线圈表示AFP和HSA之间不对应的二硫键。b. AFP-FA(粉色)和HSA-FA(绿色)的结构。脂肪酸是棕榈酸(C16:0),在AFP和HSA中分别以洋红色和深绿色表示。不同的FA结合位点用阿拉伯数字表示。c. AFP(8X1N,洋红色)和HSA(1E7H,黄绿色)子域的结构比较。FA在AFP中分别为紫色,在HSA中为深绿色。图中标出了与FA相关的氨基酸残基。
2.5 小结
AFP和HSA是白蛋白家族的成员,表现出明显的序列同源性。对它们的整体结构和各个领域的比较分析揭示了惊人的相似之处,表明了潜在的功能相似性。AFP和HSA在血液中起天然运输载体的作用,可逆地与各种内源性和外源性分子结合,以运输到不同的组织。AFP和HSA之间的一个显著相似之处是它们对FA的高亲和力。AFP中FA结合口袋的结构特征在鉴定合适的FA治疗分子中起着至关重要的作用。例如,AFP结合口袋的大小决定了最佳FA链长度,以获得更高的亲和力和更长的体内半衰期。此外,口袋入口周围氨基酸残基的极性和电荷会影响FA结合。因此,掺入适当的修饰基团可以增强AFP和FA之间的亲和力。然而,AFP和HSA并不相同,HSA比AFP具有更多的结合位点,这可能使其能够与更多的生物分子相互作用。这可能是HSA成为成年人血液中最丰富的运输载体的原因之一。
参考文献
Liu K, Wu C, Zhu M, et al. Structural characteristics of alpha-fetoprotein, including N-glycosylation, metal ion and fatty acid binding sites[J]. Commun Biol, 2024,7(1):505.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302