深入探讨甲胎蛋白(AFP)及其在肝细胞癌(HCC)中的应用
1.AFP概述
甲胎蛋白(AFP)是一种糖蛋白,它在人类早期胚胎发育和维持妊娠期间免疫平衡方面扮演着至关重要的角色。该蛋白主要分为AFP-L1、AFP-L2和AFP-L3三种亚型,这些亚型各自具有不同的凝集素结合能力,并且在各种病理状态下,它们的数量会发生相应的变化。
2.AFP的生化结构
AFP的分子量约为70 kDa,由一条包含590个氨基酸残基的单肽链构成,并通过15个二硫键(S-S)桥保持其稳定性。AFP含有三个结构域:I、II和III,每个结构域大约由195个氨基酸残基组成,这些结构域在人类、大鼠、小鼠和牛中高度保守。
AFP独特的结构赋予其高度的构象稳定性,使其能够在广泛的pH范围(4.5-10.5)、低于70°C的温度、尿素浓度低于7.5 M以及盐酸胍浓度低于2.0 M的条件下,依然保持其天然结构。在临床应用中,这种稳定性对于确保AFP在运输或储存过程中的完整性至关重要。
3.AFP的生理功能
在免疫调节方面,AFP扮演着重要的角色,特别是在维持妊娠期间的免疫平衡上,它通过抑制母体的免疫反应来有效防止对胎儿的排斥。到了妊娠的第12周左右,随着卵黄囊的退化,胎儿肝脏成为AFP产生的主要部位。出生后,控制AFP的调节机制发生转变。具体来说,那些在胎儿阶段促进AFP基因转录的AFP增强子,通常在出生后会受到基因启动子的抑制。然而,这些增强子并未停止活动,而是转而维持整个成年期白蛋白基因的转录。
母体AFP水平受胎儿大小及胎龄的显著影响,这两者共同作用于母体和胎儿循环系统中的AFP浓度。进一步的研究发现,母体AFP水平与脐带动脉血及静脉血中的AFP水平密切相关。因此,母体AFP水平可被视作胎儿是否存在异常的重要指标之一,特别是针对神经管缺陷和唐氏综合征等疾病的筛查。目前,AFP已被纳入产前筛查测试体系中。
4.AFP的病理功能
AFP作为首个被确认的癌蛋白,常被纳入肝细胞癌(HCC)的筛查策略中。在成人体内,AFP的表达量通常维持在较低水平,一旦其水平升高,可能提示存在某些病理状态,如活动性肝再生、肝炎或是癌症等。AFP不仅可由HCC分泌,还可能由其他具有侵袭性的肿瘤,如生殖细胞瘤、肝母细胞瘤产生,且这种情况多见于体积较大、分化程度低、伴有血管侵犯的肿瘤。因此,AFP水平在HCC中扮演着重要的预后指示角色。
4.1免疫抑制作用
在肿瘤学领域,肿瘤源性AFP(tAFP)对多种细胞类型展现出免疫抑制效应,这些细胞包括自然杀伤细胞、T细胞和树突状细胞(DC)。通过作用于这些广泛的免疫细胞,tAFP在HCC的发病机制中发挥重要作用。此外,免疫抑制作用的另一个潜在机制涉及调节性抑制细胞作用。AFP并不直接作用于T细胞,而是通过抑制单核细胞的炎症反应,间接影响T细胞的功能。
4.2免疫逃逸
来自肝癌细胞的AFP可以通过PI3K/Akt通路触发M0巨噬细胞极化为M2表型,从而阻止吞噬作用。除了促进巨噬细胞向M2表型极化外,AFP还阻碍NK细胞和T淋巴细胞的增殖,帮助肝癌免疫逃逸。此外,AFP与脂质元素(如可改变细胞代谢的多不饱和脂肪酸)的相互作用可影响DC和自然杀伤细胞的特征、功能和代谢途径。
4.3促进癌细胞发展
AFP对癌细胞维持其未分化状态及传播能力具有显著影响。众多研究显示,AFP通过一系列机制在肿瘤发展过程中扮演重要角色,这些机制包括抑制细胞凋亡、加速肿瘤增殖、以及促进肿瘤的迁移、侵袭和转移。AFP可能通过调控p53/Bax/cytochrome c/caspase-3通路来抑制细胞凋亡过程。其中,caspase-3信号级联是AFP抑制肝细胞癌(HCC)细胞凋亡的一个重要途径。值得注意的是,AFP能够直接与caspase-3的活性位点结合,从而阻止其被肿瘤坏死因子相关的凋亡诱导配体所激活。
AFP促进HCC增殖的作用机制主要涉及激活cAMP/PKA和PI3K/AKT/mTOR信号通路。细胞外的AFP与细胞膜表面的AFP受体相结合,这一结合导致细胞内cAMP水平上升,并随之增强PKA的活性。这一系列反应进一步触发癌基因(例如c-Fos、c-Jun和N-Ras)以及突变型p53和p21蛋白的过度表达,从而推动肿瘤增殖。另一方面,细胞内的AFP与PTEN蛋白结合激活PI3K/AKT/mTOR信号通路,导致缺氧诱导因子-1α(HIF-1α)的转录水平上调。随后,HIF-1α进入细胞核,与Src、Ras和CXCR4等基因的启动子结合,诱导HCC细胞的增殖。
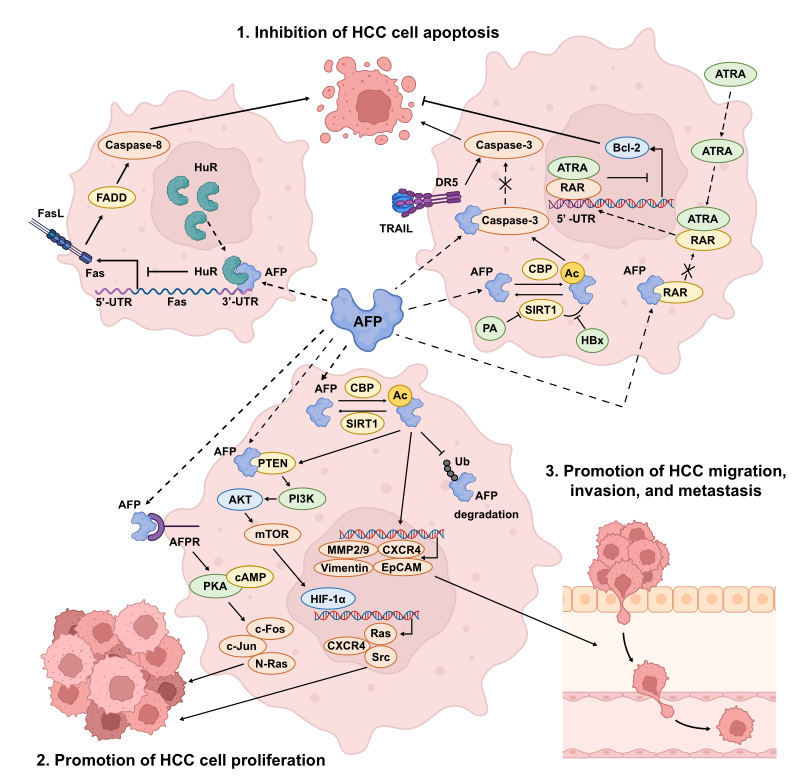
图1.AFP与HCC相关的生物学途径
缩写:Ac,乙酰化;AFP,甲胎蛋白;AFPR,AFP受体;ATRA,全反式维甲酸;CBP,CREB结合蛋白;CXCR4,CXC趋化因子受体4;DR5,死亡受体5;FADD,Fas相关死亡域;FasL,Fas配体;HBx,乙型肝炎病毒X蛋白;HIF-1α,缺氧诱导因子1α;HuR,人抗原R;MMP,基质金属蛋白酶;PA,棕榈酸;RAR,视黄酸受体;SIRT1,sirtuin 1型;TRAIL,肿瘤坏死因子相关凋亡诱导配体;Ub,泛素;UTR,未翻译区域。
5.AFP升高的原因
AFP水平的升高可归因于肝脏原因和非肝脏原因。在肝脏肿瘤条件下,HCC是最为人所熟知的引发AFP水平升高的原发性恶性肿瘤。表1还详细列举了非肿瘤性肝脏疾病,如肝硬化、病毒复制活跃的病毒性肝炎,以及其他肝脏疾病,这些疾病同样可能导致AFP水平升高。非肝脏因素引起的AFP水平升高,也涵盖了多种情形,其中包括生殖细胞肿瘤、胃癌等肿瘤性状况,以及正常妊娠状态、各类胎儿异常和自身免疫性病症等非肿瘤性状况。鉴于AFP升高的潜在原因多种多样,当遇到AFP水平上升时,必须采取详尽且细致的鉴别诊断流程。
表1.AFP水平升高的病因
| AFP升高的肝脏原因 | AFP升高的非肝脏原因 | ||
|---|---|---|---|
| 肿瘤性 | 非肿瘤性 | 肿瘤性 | 非肿瘤性 |
| 肝细胞癌 | 肝硬化 | 生殖细胞肿瘤 (睾丸和卵巢) |
正常怀孕/婴儿期 |
| 肝内胆管癌 | 暴发性急性肝炎 | 胃癌 | 结肠炎 |
| 肝转移 | 病毒性肝炎 | 败血症 | |
| 代谢功能障碍相关的脂肪性肝病 | 胎儿疾病 (腹裂、神经管缺陷) |
||
| 胆道梗阻 (肝内和肝外) |
遗传性酪氨酸血症1型 | ||
| 药物性肝损伤 | 遗传性AFP持续存在 | ||
| 酒精性肝病 | Beckwith-Wiedemann综合征 | ||
| 肝脏炎性假瘤 | 系统性红斑狼疮 | ||
| 新生儿肝炎 | 先天性巨结肠 | ||
| 大面积肝坏死 | 共济失调毛细血管扩张症 | ||
| 自身免疫性肝炎 | |||
| Wilson病 | |||
| 血色病 | |||
6.AFP在肝细胞癌(HCC)中的应用
6.1检测/筛选生物标志物
AFP是首个获得认可的癌胚生物标志物,不仅可用于HCC诊断,还可用于区分原发性和转移性肝肿瘤。然而,作为HCC的独立生物标志物,AFP的局限性显而易见:大部分早期HCC患者并未表现出AFP水平升高,且在非病毒性HCC病例中,AFP水平通常较低。但值得注意的是,将AFP与超声检查相结合,可以提高早期HCC检测的敏感性。尽管美国肝病研究协会(AASLD)和亚太肝脏研究协会(APASL)推荐AFP用于HCC超声监测,但欧洲肝脏研究协会(EASL)对此并未给予认可。
6.2早期HCC检测
在HCC诊断领域的不断进步中,探寻新型生物标志物以强化AFP的检测精度显得极为关键。将AFP与其他多种生物标志物联合应用,如AFP-L3%、脱-γ-羧基凝血酶原(DCP)、Glypican-3、GP73、热休克蛋白90 α、中期因子以及骨桥蛋白不仅提高了AUROC在早期HCC筛查中的效能,而且相较于仅使用AFP检测,展现出了更优越的性能。
注:AFP-L3是一种AFP变体,主要出现在HCC患体内,可特异性结合Lens culinaris凝集素。它与多项肿瘤晚期特征相关,包括肿瘤较大、门静脉侵犯、肿瘤分期和较高的分级。AFP-L3占总AFP的百分比,称之为AFP-L3%,已被广泛研究并视为一种潜在的HCC生物标志物。尽管与AFP相比,AFP-L3%在检测早期HCC时展现出了92%的高特异性,但在针对2期和3期的生物标志物研究中,其敏感性相对较低,仅为34%。
6.3预后生物标志物
AFP已被证明是一个强大的预后生物标志物,多个HCC预后模型证实了其独立的预后预测效能。AFP水平的变化能够有效地反映肿瘤的进展以及对治疗的响应情况。具体而言,当AFP水平显著升高,特别是超过9000ng/mL时,与患者的无病生存期缩短密切相关,而当AFP水平高于14000ng/mL时,则与总生存期(OS)缩短有关,这表明高AFP水平可能预示着疾病晚期阶段。目前,MESH系统、台北综合评分系统以及肝癌意大利计划(CLIP)评分等多个预后评分体系,均将AFP纳入预测指标,用于精确预测HCC患者的OS。
6.4肝移植患者选择及结局预测
AFP在评估肝移植资格中的作用日益凸显,为提高患者预后提供新途径。联合器官共享网络数据显示,移植前AFP水平可独立预测HCC复发患者生存率。AFP≥500ng/mL者死亡风险较≤20ng/mL者增1.6倍(p<0.001)。此外,纽约癌症研究院(NYCA)的评分体系引入了动态的AFP变化率,这一创新性的方法在精确筛选肝移植候选者方面展现出了巨大的潜力。与传统的静态AFP测量相比,动态的AFP变化率能够更深入地反映患者的病情变化,从而有助于医生做出更为精细的移植决策。研究表明,基于AFP的预后模型在预测准确性方面高于经典的Milan标准,为肝移植候选者的选择提供了一种新的、更为准确的方法。通过综合AFP等生物标志物信息,我们可以进一步优化移植候选人分层,这不仅有助于提升移植术后的患者预后,还有望促进肝病学资源更加公平、高效的分配。
Metroticket 2.0模型整合AFP数据,提升了肝移植后HCC死亡率的预测能力。与此同时,多种结合AFP的多因素预测体系也相继得到发展,包括MORAL评分、nomogram、上海标准、RETREAT及R3-AFP模型等,这些体系共同提供了更为全面和深入的预后分析视角。此外,AFP-L3与DCP双重生物标志物模型在预测肝移植后复发方面展现出高预测性。前瞻性研究显示,AFP-L3的比例≥15%,且DCP浓度≥7.5 ng/mL,是早期HCC复发风险的有力指标。
7.总结
甲胎蛋白(AFP)作为一种重要的生物标志物,在肝细胞癌(HCC)的诊断、预后和治疗中发挥着重要作用。通过深入研究AFP的结构与功能、调控机制以及与其他生物标志物的联合应用,可以进一步提高AFP在HCC中的应用价值。同时,加强基础研究与临床转化的结合是推动AFP临床应用的关键。未来,随着研究的不断深入和技术的不断发展,AFP有望在HCC的诊断和治疗中发挥更大的作用。
参考文献
Yeo YH, Lee YT, Tseng HR, et al. Alpha-fetoprotein: Past, present, and future. Hepatol Commun[J]. 2024,8(5):e0422.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302