为何MTBR-tau243能成为最新的阿尔茨海默病生物标志物
阿尔茨海默病(AD)的两个决定性特征之一是聚集的不溶性tau蛋白。由于tau蛋白聚集体与临床症状密切相关,因此药物开发和临床诊断需要成本效益高且易于获得的特异性液体生物标志物来追踪tau蛋白聚集物。然而,最新研究表明,目前可用的液体生物标志物尚无法特异性地监测tau蛋白聚集物。Horie K等人发现,含有第243位残基的tau微管结合区(MTBR-tau243)是一种新型的脑脊液生物标志物,能够特异性地反映不溶性tau蛋白聚集体。
1.Tau-PET检测精准性与局限性并存
随着对以tau蛋白为靶点的阿尔茨海默病(AD)治疗策略兴趣的不断增加,目前迫切需要开发对不溶性tau蛋白聚集体特异且可靠的生物标志物。这些生物标志物对于深入理解AD的病理机制和评估治疗效果至关重要。Tau-PET,一种使用放射性配体结合纤维状tau蛋白的PET技术,能够反映大脑中不溶性、AD特异性tau聚集体的负荷。Tau-PET成像研究揭示,即使在AD症状出现之前的早期阶段,不溶性tau聚集体也与认知能力下降密切相关,使其成为目前最精确的AD预后标志物之一。然而,PET成像成本昂贵,且需要复杂的基础设施支持,限制了其在高度专业化中心之外的应用。相较之下,液体生物标志物成本更低,临床上更易于获取和应用。
2.p-tau液体生物标志物非特异性反映tau病理
目前,临床上广泛应用的tau液体生物标志物包括N端或中端的总tau(t-tau)以及由tau蛋白第224位残基附近裂解而产生的磷酸化tau,如p-tau181、p-tau217和p-tau231。在临床前AD中,这些p-tau的血浆和脑脊液浓度在新皮层中不溶性tau聚集体出现之前就已经升高。因此,这些生物标志物与淀粉样蛋白斑块的相关性可能高于与不溶性tau聚集体的相关性。具体例证如下:
①临床试验表明,针对清除淀粉样蛋白斑块的抗淀粉样蛋白被动免疫疗法能有效减少脑脊液和血浆中的t-tau、p-tau181和p-tau217水平。
②神经病理学和影像学研究也证实了这些液体生物标志物与淀粉样蛋白斑块之间的紧密联系。
③动物研究在具有β淀粉样蛋白(Aβ)病理的小鼠模型中发现,即使没有观察到tau蛋白聚集,脑脊液中的t-tau和p-tau也会增加。
综上所述,血浆和脑脊液中N端至中部区域的t-tau和p-tau浓度更多地反映了与AD相关的淀粉样蛋白斑块病理,而不是不溶性tau聚集物。因此,现有的液体生物标志物并不能特异性地指示AD相关的tau病理。
3.新型AD tau病理特异性液体生物标志物
Horie K等人评估了一种新型的脑脊液生物标志物——MTBR-tau243。这种含有微管结合区(MTBR)的tau蛋白是大脑中不溶性tau聚集体的关键成分,而特定的含有第243位残基的MTBR-tau(MTBR-tau243)在人脑脊液中存在,并与tau PET成像和疾病进展紧密相关。研究表明,MTBR-tau243是预测tau PET指标和认知障碍的最佳生物标志物之一。
4.MTBR-tau243的性能研究
4.1研究对象
实验参与者源自两个不同的组:BioFINDER-2和Knight ADRC。BioFINDER-2组共有448名参与者,其中大多数存在认知障碍(281人,占63%):包括81名认知未受损且Aβ阴性(CU−)个体,79名认知未受损但Aβ阳性(CU+)的个体,90名Aβ阳性的轻度认知障碍(MCI+)患者,102名Aβ阳性的AD痴呆(AD+)患者,以及96名其他类型痴呆(非AD)患者。该队列参与者的平均年龄为70.9±8.4岁(平均值±标准差),其中女性有221人(占49.3%),APOEε4携带者有258人(占57.6%)。
Knight ADRC组则包含219名参与者,其中大多数认知未受损(171人,占78%):包括83名CU−个体、88名CU+个体、35名MCI+患者和13名AD+患者。该队列参与者的平均年龄为71.2±6.6岁,女性有112人(占51.1%),APOEε4携带者有96人(占43.8%)。
4.2研究方法
采用新开发的免疫沉淀/质谱(IP/MS)技术对脑脊液中的tau蛋白进行定量分析,包括MTBR-tau243以及磷酸化可溶性tau的比例(pT181/T181、pT205/T205、pT217/T217和pT231/T231)。MTBR-tau243的抗体HJ32.11和HJ34.8是通过将tau蛋白的225-242氨基酸序列和226-264氨基酸序列分别与锁孔帽贝血蓝蛋白(KLH)融合后,免疫tau蛋白敲除小鼠得到的。HJ32.11的结合位点靠近243位残基,而HJ34.8则靠近260位残基。磷酸化可溶性tau的比例(% p-tau/t-tau)是通过在同一样本中测量磷酸化肽与非磷酸化肽的比值来计算的。BioFINDER-2组中,淀粉样蛋白PET和tau PET成像分别使用了[18F]flutemetamol和[18F]RO948作为示踪剂。Knight ADRC组中,参与者的淀粉样蛋白PET使用了[18F]florbetapir(也称为[18F]AV45)或[11C]PiB,而tau PET则采用了[18F]flortaucipir(也称为[18F]AV1451)作为示踪剂。
4.3研究结果
4.3.1CSF与PET生物标志物的关联性
通过应用考虑年龄和性别因素的线性回归模型,我们评估了CSF中的MTBR-tau243、pT181/T181、pT205/T205、pT217/T217和pT231/T231与淀粉样蛋白PET和tau PET病理学测量结果之间的相关性。分析不仅涵盖了所有参与者的数据,还特别针对淀粉样蛋白阳性亚组(Aβ+)进行了区分。研究结果显示,与tau-PET病理学测量结果相关性最高的CSF指标是MTBR-tau243的浓度,而与淀粉样蛋白PET病理学测量结果相关性最高的CSF指标是pT217/T217。尽管pT217/T217与tau-PET也显示出较强的相关性,但在tau-PET病理学测量结果显著之前,pT217/T217的值会非线性地大幅上升,一旦tau-PET超过阈值,pT217/T217的值则趋于稳定。这表明pT217/T217主要通过与Aβ病理数量的定量关系与tau病理学测量结果相关联。
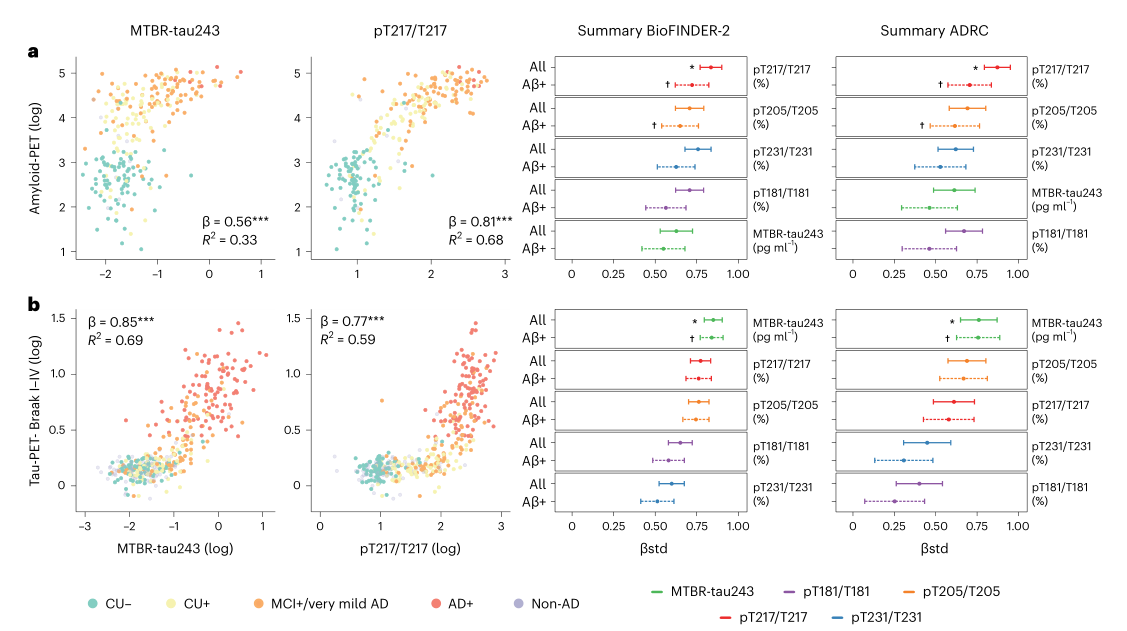
图1.CSF与PET生物标志物之间的关联性
注:图中左侧的前两列展示了BioFINDER-2组中MTBR-tau243和pT217/T217与淀粉样蛋白-PET(n=268)及tau-PET(n=443)之间的散点图,颜色根据诊断和淀粉样蛋白状态进行区分。通过应用考虑年龄和性别的线性回归模型,得出β值、P值(星号表示)和R2值。图的右侧分别展示了BioFINDER-2组(n=219)和Knight ADRC组(除pT231/T231外,n均为184)中CSF生物标志物与淀粉样蛋白或tau-PET之间的标准化β值(βstd)。实线和虚线分别表示所有参与者或仅淀粉样蛋白阳性参与者的标准化β值(中心点)及其95%置信区间(CI)(BioFINDER-2组:淀粉样蛋白-PET,n=172,tau-PET,n=287;Knight ADRC组,n=136;除pT231/T231外,其余n=117)。星号(或十字)表示在所有参与者(或仅淀粉样蛋白阳性参与者)组中,标准化β值最高或有显著性差异的结果,没有星号或叉号的生物标志物则表示相关性较弱。
不同Braak阶段(包括内嗅区(Braak I)、颞部(Braak III-IV)和新皮质(Braak V-VI))的CSF tau水平与tau-PET之间的相关性分析显示,在淀粉样蛋白阳性亚组(Aβ+)中,脑脊液MTBR-tau243与各Braak区域的tau-PET相关性最强(BioFINDER-2组中β值分别为0.85、0.84和0.76;Knight ADRC组中β值分别为0.83、0.84和0.76)。
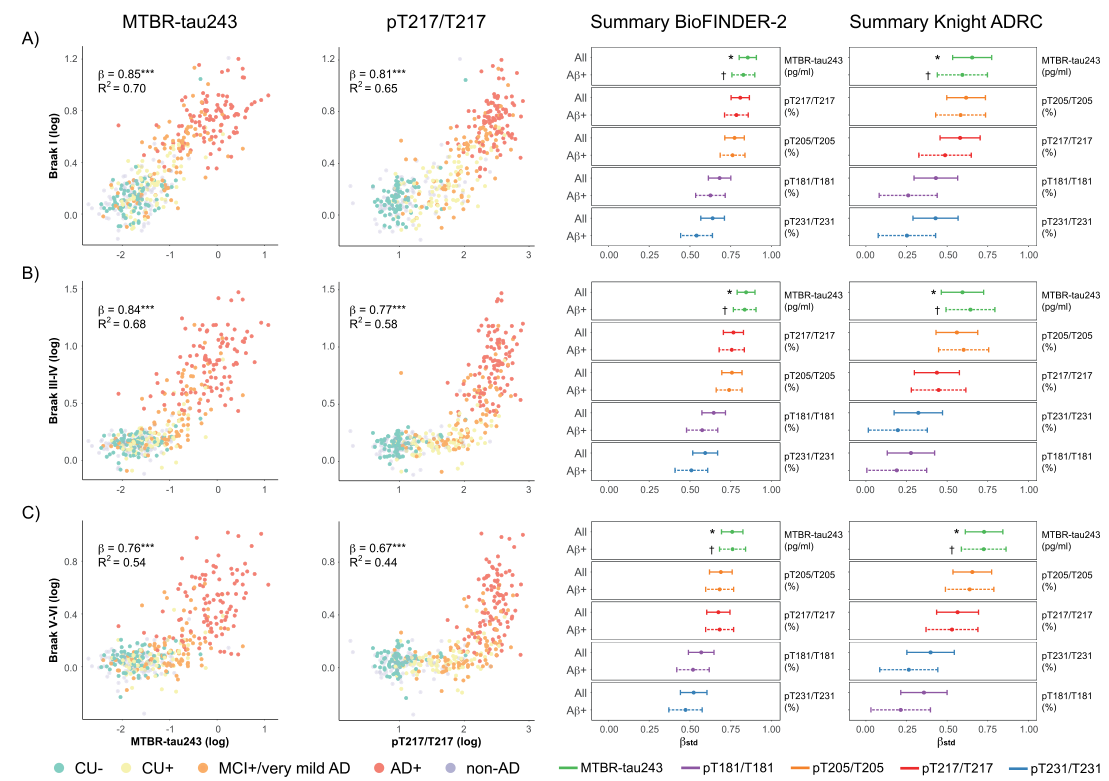
图2.CSF生物标志物与不同Braak区域tau-PET的相关性
注:左侧展示了BioFINDER-2组中MTBR-tau243和pT217/T217与tau-PET的散点图。实线和虚线分别表示所有参与者及仅淀粉样蛋白阳性参与者的标准化β值(中心点)及其95%置信区间(CI)(BioFINDER-2组:n=287;Knight ADRC组,n=136)。
4.3.2CSF生物标志物变化与AD病理的相关性
在BioFINDER-2和Knight ADRC两个研究组中,研究发现脑脊液中MTBR-tau243的浓度变化与tau病理(通过tau-PET进行评估)之间的相关性更为显著。同样,脑脊液中pT217/T217的浓度变化与Aβ病理(通过淀粉样蛋白PET进行评估)之间的相关性也更为突出。相比之下,脑脊液中pT205/T205的浓度变化与tau病理和Aβ病理之间的相关性没有表现出统计学上的显著差异。
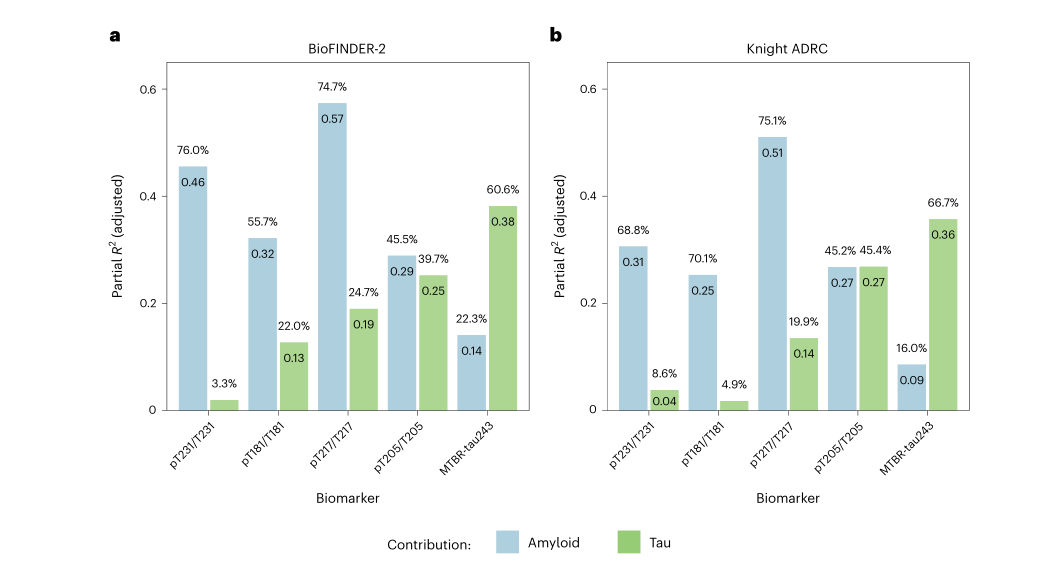
图3.淀粉样蛋白-PET和tau-PET水平对CSF生物标志物变化的解释
注:在图3a和图3b中,柱状图展示了部分R²值,而柱状图上方的数值表示BioFINDER-2和Knight ADRC组中部分R2占模型总R2的百分比。对于每个生物标志物和研究组,我们采用个体的CSF生物标志物数据作为因变量,并将淀粉样蛋白与tau的测量值作为线性回归模型的自变量,同时对年龄和性别进行了校正,以计算这些R²值。由于潜在的共享方差,这些百分比的总和可能不会达到100%。
4.3.3CSF生物标志物的纵向变化
本研究利用BioFINDER-2组的纵向数据,探讨了基于淀粉样蛋白(Aβ)和tau病理状态(标记为+和-)的CSF生物标志物变化。研究发现,在5个CSF tau生物标志物中,仅有MTBR-tau243在Aβ阳性但tau阴性(A+T−)组与Aβ和tau双阳性(A+T+)组之间的变化率表现出显著增加,这可能意味着MTBR-tau243能够用于追踪以新皮层tau聚集为特征的AD症状期的纵向变化。
对于其他磷酸化tau(p-tau)生物标志物,包括pT181/T181、pT217/T217和pT231/T231,在从Aβ阴性且tau阴性(A-T-)到Aβ阳性且tau阴性(A+T-)的转变过程中,其增长率显著增加;而在从A+T−到A+T+的转变过程中,增长率并没有显著增加或降低。这表明,当不溶性tau聚集体开始在新皮层沉积时,这些p-tau指标的变化率可能在疾病晚期趋于稳定或下降。因此,传统的p-tau指标可能并非直接反映AD中tau病理学变化的理想指标。
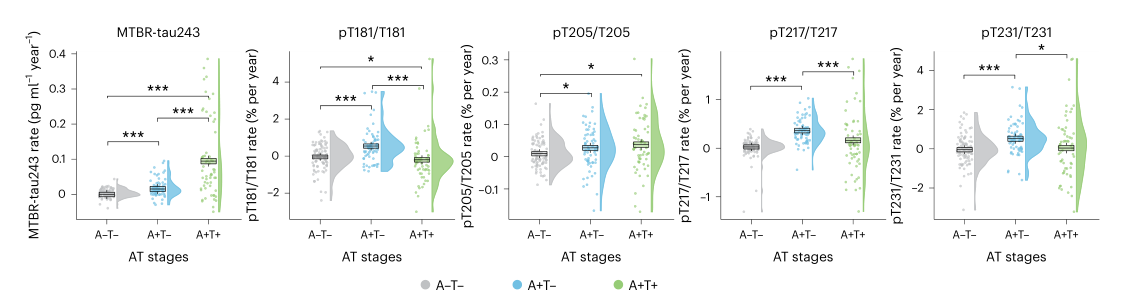
图4.基于基线淀粉样蛋白和tau状态的纵向CSF生物标志物变化
注:本研究利用BioFINDER-2组的纵向数据,分析了基于淀粉样蛋白(Aβ)和tau病理状态(标记为+和-)的脑脊液(CSF)生物标志物变化。在时间交互作用显著的情况下,通过线性混合模型对不同组别(A−/T−、A+/T−和A+/T+)的CSF生物标志物纵向变化轨迹进行比较。淀粉样蛋白状态通过CSF中Aβ42/40比值来评估,而tau病理状态则通过tau-PET成像来确定。各组的纵向变化轨迹以箱线图形式呈现,这些箱线图基于线性混合模型生成(中间的带表示中位数,下端和上端的铰链分别对应第一和第三四分位数,须线表示最大值/最小值或距离铰链1.5倍四分位数范围的值,取两者中较小的一个)。采用Kruskal-Wallis检验来评估所有组之间的差异,并进行成对Wilcoxon检验以进行事后比较。星号表示双侧检验的P值,P<0.001;*P<0.050;**P<0.010;***P<0.001;未对多重比较进行校正。
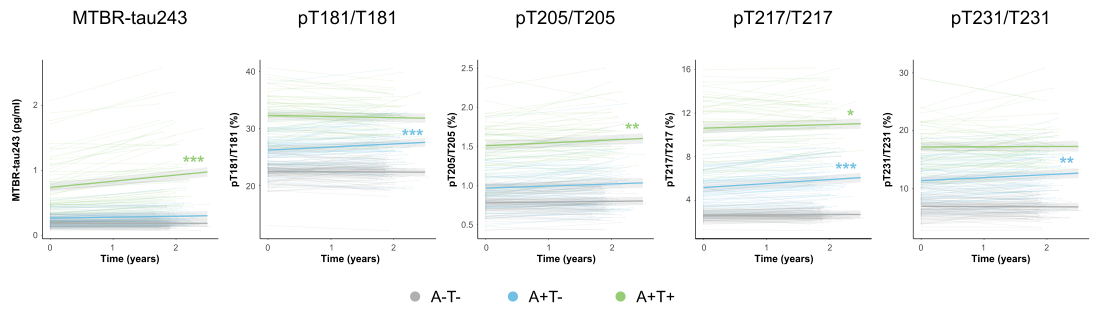
图5.基于基线“A”和“T”状态的纵向CSF生物标志物变化轨迹
注:本图展示了BioFINDER-2组中纵向脑脊液(CSF)数据。图中描绘了基于基线淀粉样蛋白(A)和tau(T)状态的个体(以阴影线表示)和群体(以粗线表示)CSF生物标志物水平随时间的变化轨迹。与参考组(A-T-)之间的统计学差异通过相应颜色的星号标识;*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。淀粉样蛋白阳性的参与者是根据之前验证的CSF Aβ42/40临界值(CSF Aβ42/40 < 0.08)来确定的。tau阳性的评估是基于meta-ROI区域中tau-PET的标准化摄取值比(SUVR),其中Braak I-IV阶段的SUVR >1.32被认定为tau阳性。
4.3.4CSF、PET生物标志物与MMSE评分的相关性
研究团队评估了BioFINDER-2和Knight ADRC组中CSF和PET生物标志物与简易精神状态检查量表(MMSE)评分之间的相关性,并运用了控制年龄、性别和教育年限的线性回归模型进行分析。研究发现,在所有参与者以及淀粉样蛋白阳性参与者中,tau-PET与MMSE评分的相关性超过了任何CSF生物标志物。其中,MTBR-tau243是CSF生物标志物中与MMSE评分相关性最强的(BioFINDER-2组中β=-0.65,95%置信区间为-0.74至-0.57;Knight ADRC组中β=-0.54,95%置信区间为-0.67至-0.42,两者的P值均小于0.001)。特别值得关注的是,MTBR-tau243与tau-PET在与MMSE评分的相关性上没有显著差异,这表明CSF中的MTBR-tau243有可能作为tau-PET在临床应用中的一个有效替代指标。
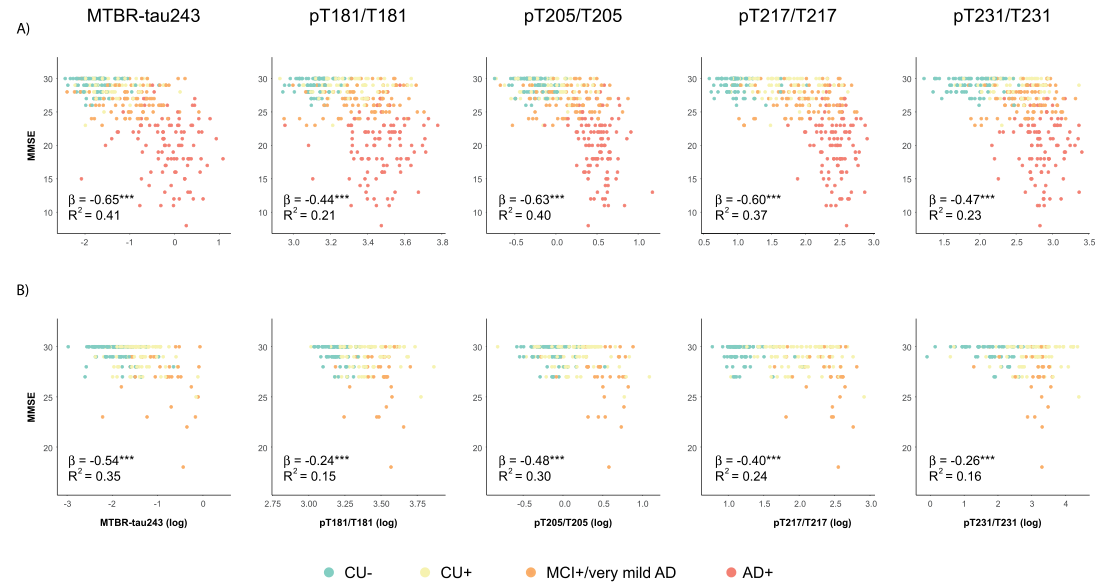
图6.CSF生物标志物与MMSE评分之间的相关性
注:A)和B)分别代表BioFINDER-2和Knight ADRC组的数据,散点图的颜色编码依据诊断和淀粉样蛋白状态进行区分。在BioFINDER-2组中,橙色圆点标识了MCI(轻度认知障碍)阳性参与者;而在Knight ADRC组中,橙色圆点则代表非常轻度AD患者。淀粉样蛋白阳性的参与者是根据先前验证的CSF Aβ42/40临界值来确定的(BioFINDER-2组中CSF Aβ42/40<0.08,Knight ADRC组中CSF Aβ42/40<0.0673)。
4.4结论
无论是在探讨脑脊液(CSF)生物标志物与tau-PET和MMSE评分的相关性,还是考察CSF生物标志物浓度差异及其纵向变化与病理状态的关联,MTBR-tau243均显示出与tau病理学的紧密联系。研究证实,CSF MTBR-tau243特异性反映了发生AD进展晚期的聚集性tau病理的变化,并与临床和认知症状相关。建议将MTBR-tau243作为不溶性tau聚集体病理(T)的液体生物标志物,取代常用的p-tau,用于评估AD tau蛋白病及独立于淀粉样蛋白效应的药物治疗效果。
参考文献
Horie K, Salvadó G, Barthélemy NR, et al. CSF MTBR-tau243 is a specific biomarker of tau tangle pathology in Alzheimer's disease[J]. Nat Med, 2023, 29(8): 1954-1963.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302